အရွယ်ရောက်ပြီးအမျိုးသမီးတွေအားလုံးနီးပါးမှာမကြာခင်ဖြစ်လာနိုင်တဲ့၊သားဥအိမ်ကင်ဆာ၊ရင်သားကင်ဆာ၊သားအိမ်နံရံကင်ဆာ၊သားအိမ်ခေါင်းကင်ဆာ၊သားအိမ်ဝကင်ဆာနဲ့မွေးလမ်းကြောင်းကင်ဆာတွေနဲ့အတူအမျိုးသားတွေမှာဖြစ်လာမဲ့ဆီးကြိတ်ကင်ဆာ၊ဝေးစေ့ကင်ဆာတွေဟာဘာကြောင့်မကြာခင်လူတိုင်းနီးပါးမှာဖြစ်လာနိုင်တယ်လို့ပြောနိုင်တာလဲ၊ဒီရောဂါတွေဘာကြောင့်အစပြုဖြစ်လာရသလဲ၊ဆိုတဲ့အကြောင်းတရားတွေကိုရေးပေးပါမယ်။အမျိုးသမီးတွေမှာရောအမျိုးသားတွေမှာရောမျိုးပွားအင်္ဂါအစိတ်အပိုင်းမှာရှိနေတဲ့ဆဲလ်တွေအားလုံးရဲ့မျက်နာပြင်အပေါ်ဖက်မှာ(Estrogen)လို့ခေါ်တဲ့အမျိုးသမီးမဟော်မုန်းဓါတ်ကိုလက်ခံပေးနိုင်စွမ်းရှိတဲ့လက်တံ(Receptors)တွေပါရှိနေတတ်ကြပါတယ်။ဆိုလိုတာကသဘာဝအားဖြင့်အမျိုးသမီးငယ်လေးတစ်ယောက်ဟာ(၁၃)နှစ်(၁၄)နှစ်လောက်မှာအပျိုဖေါ်ဝင်လာပြီဆိုရင်၊အဲဒီအမျိုးသမီးလေးရဲ့မျိုးဥအိမ်က(Estrogen)လို့ခေါ်တဲ့အမျိုးသမီးမဟော်မုန်းဓါတ်ကိုစတင်ပြီးထုတ်လုပ်ပေးပါတယ်။ဒီလိုမျိုးဥအိမ်ကထုတ်ပေးလိုက်တဲ့မဟော်မုန်းဓါတ်ဟာအမျိုးသမီးလေးရဲ့မျိုးပွားအင်္ဂါတွေကဆဲလ်တွေရဲ့ဟော်မုန်းလက်ခံပေးတဲ့လက်တံ(Estrogen receptors)တွေမှာသွားပေါင်းစီးမိပြီး၊ဒီဟော်မုန်းဓါတ်ရဲ့ပြုပြင်မှုကြောင့်မျိုးပွားအင်္ဂါတွေဖွံ့ဖြိုးကြီးထွားလာပြီးတော့၊ကလေးဘဝကနေ၊အိမ်ထောင်သားမွေးနိုင်တဲ့လူကြီးဘဝကိုတဖြေးဖြေးပြောင်းလဲလာပါတယ်။ဒီအက်စထိုဂျင်ဟော်မုန်းဓါတ်ကိုအမျိုးသမီးတွေအသက်(၅၀)ပါတ်ဝန်းကျင်လောက်အထိသွေးမဆုံးမချင်းသားဥအိမ်ကနေလစဉ်အမြဲထုတ်ပေးနေပါတယ်။ဒီဟော်မုန်းဓါတ်ကြောင့်မိန်းကလေးတွေရဲ့အသွင်အပြင်တွေ၊အသံတွေကယောင်္ကျားလေးတွေနှင့်မတူညီပဲမိန်းမဆန်ပြီးကွဲပြားခြားနားနေရခြင်းဖြစ်ပါတယ်။မိန်းကလေးဆန်ဆန်ကိုယ်လုံးကိုယ်ပေါက်တွေရှိလာပြီးလှပနေဖို့အတွက်ကလဲဒီဟော်မုန်းကပဲအဓိကလုပ်ဆောင်ပေးပါတယ်။လင်ယူသားမွေး၊ကလေးမွေးအစရှိတဲ့မျိုးပွားမှုကိစ္စတွေမှာလဲဒီဟော်မုန်းဓါတ်ကအဓိကကျနေပါတယ်။ကျန်းမာတဲ့အမျိုးသမီးအဖြစ်ရပ်တည်ဖို့၊အမျိုးသမီးအင်္ဂါအစိတ်အပိုင်းတွေကျန်းမာသန်စွမ်းဖို့ကဒီအက်စထရိုဂျင်ဟော်မုန်းကမရှိမဖြစ်လိုအပ်လှပါတယ်။
———-
သို့သော်အခုခေတ်မှာပြဿနာအကြီးအကျယ်တက်လာတာကဒီလိုမဟော်မုန်းနဲ့အလားသဏ္ဍန်တူပြီးအကြီးအကျယ်ဒုက္ခပေးနိုင်တဲ့မသန့်ရှင်းတဲ့ပါတ်ဝန်းကျင်ပြင်ပလူလုပ်တဲ့ဓါတုပစ္စည်းတွေကလာတဲ့ဆင်တက်တစ်ဇီနိုအက်စထိုဂျင်(synthetic xenoestrogens)လို့ခေါ်တဲ့ဓါတုဗေဒပစ္စည်းတွေကြောင့်ဖြစ်လာတဲ့မဟော်မုန်းဓါတ်အတုတစ်မျိုးဟာခန္ဒာကိုယ်ထဲကိုဝင်ရောက်လာပြီး၊မဟော်မုန်းကဲ့သို့မျိုးပွါးအင်္ဂါတွေရဲ့ဟော်မုန်းလက်ခံပေးတဲ့လက်တံတွေမှာဝင်ရောက်ပေါင်းဖက်ပြီးတော့အကြီးအကျယ်ဒုက္ခပေးတော့တာပါပဲ။ဒီပြင်ပဓါတုဗေဓပစ္စည်းတွေကလာတဲ့ဇီနိုအက်စထိုဂျင်(အက်စထိုဂျင်အတု)ဟော်မုန်းတွေဟာအမျိုးသမီးတွေရဲ့မျိုးပွားအင်္ဂါအစိတ်အပိုင်းတွေကဆဲလ်တွေကိုပေါင်းစပ်လိုက်ပြီးတော့၊ကောင်းနေတဲ့ဆဲလ်တွေကနေကင်ဆာဆဲလ်တွေဖြစ်အောင်၊ကင်ဆာဆဲလ်တခုကနေရာချီထောင်ချီတဲ့ကင်ဆာဆဲလ်တွေအဖြစ်ပွားများလာအောင်ဝင်ရောက်စီးနင်းပြီးဒုက္ခအကြီးအကျယ်ပေးတော့တာပါပဲ။ဒီဟော်မုန်းအတုကြောင့်ကင်ဆာအဖြစ်ပြောင်းလဲသွားတဲ့ဆဲလ်တွေအားလုံးရဲ့ထူးခြားချက်ကတော့၊ကင်ဆာဆဲလ်တွေရဲ့မျက်နာပြင်အပေါ်ဖက်မှာ(Estrogen)လို့ခေါ်တဲ့မဟော်မုန်းဓါတ်ကိုလက်ခံနိုင်တဲ့လက်တံ(Receptors)တွေဟာသာမန်နဂိုတုံးကကျန်းမာနေတဲ့ဆဲလ်တွေထက်အဆပေါင်းရာနဲ့ချီပြီးတိုးပွားဖြစ်ပေါ်လာတာကိုတွေ့ရှိရပါတယ်။ဆိုလိုတာကထပ်ပြီးပြင်ပကမဟော်မုန်းအတုဇီနိုအက်စထိုဂျင်တွေဝင်လာတိုင်းကင်ဆာဆဲရဲ့လက်တံတခုအပေါ်မှာသွားပြီးပေါင်းစပ်လိုက်မိတာနဲ့၊အဲဒီကင်ဆာဆဲလ်ဟာတခဏအတွင်းရာနဲ့ထောင်နဲ့ချီပြီးပွားများလာမယ်၊ကြီးထွားလာတော့မယ်လို့ဆိုလိုပါတယ်။အဲဒီကစပြီးတော့မျိုးပွားအင်္ဂါတွေမှာကင်ဆာရောဂါတွေစပြီးဖြစ်တော့တာပါပဲ။နောက်ပိုင်းမှာကင်ဆာဆဲလ်တွေဟာအမျိုးသမီးတွေရဲ့မျိုးဥအိမ်ကထုတ်တဲ့ဟော်မုန်းအစစ်တွေနဲ့ပေါင်းစပ်မိရင်တောင်ဆဲလ်တွေကပွားများလာတော့တာပါပဲ။ဒီပြင်ပကလာတဲ့ဟော်မုန်းအတုဇီနိုအက်စထိုဂျင်တွေဟာမိန်းကလေးတွေရဲ့မျိုးပွားအင်္ဂါတွေကိုတင်မကပါဘူးယောင်္ကျားလေးတွေရဲ့မျိုးပွားအင်္ဂါတွေမှာရှိတဲ့ဆဲလ်တွေနဲ့ပေါင်းစပ်မိရင်လဲအလားတူကင်ဆာရောဂါတွေကိုစတင်ပြီးဖြစ်ပေါ်စေပါတယ်။
——————–
ဒီလိုမျိုးပွားအင်္ဂါမှာဖြစ်ပေါ်နေတဲ့ကင်ဆာတွေဟာတခြားကင်ဆာတွေနဲ့မတူပဲအီစထိုဂျင်ဟော်မုန်းကိုလက်ခံပေးပြီးတော့မှပွားများနိုင်တဲ့လက်တံတွေကပုံမှန်ကျန်းမာနေတဲ့ဆဲလ်တွေထက်အဆတစ်ရာလောက်များပြားလာပါတယ်။ဒီတော့ပုံမှန်ဆဲလ်တွေထက်ဟော်မုန်းဓါတ်အက်စထိုဂျင်ကိုပိုပြီးတော့အပြိုင်အဆိုင်သာလွန်စွာလုယူပေါင်းစည်းနိုင်ပါတေ့ာတယ်။အက်စထိုဂျင်ဟော်မုန်းဓါတ်နဲ့ပေါင်းစည်းလိုက်တာနဲ့နောက်ထပ်ကင်ဆာဆဲလ်အသစ်အသစ်တွေအဆပေါင်းများစွာပွားများလာတော့တာပါပဲ။ဒီလိုအက်စထရိုဂျင်ဟော်မုန်းဓါတ်ကိုလက်ခံနိုင်တဲ့လက်တံပါရှိပြီးဟော်မုန်းဓါတ်ရတော့မှပွားများနိုင်တဲ့ကင်ဆာဆဲလ်တွေကို(Estrogen receptors positive=ER positive)ဆဲလ်တွေလို့ခေါ်ပါတယ်။အများအားဖြင့်ရင်သားကင်ဆာ၊သားအိမ်ကင်ဆာ၊မျိုးဥကင်ဆာ၊ဆီးကြိတ်ကင်ဆာ၊ဝေးစေ့ကင်ဆာ၊အစရှိတဲ့မျိုးပွားအင်္ဂါတွေနားမှာဖြစ်ပေါ်လာတဲ့ကင်ဆာရောဂါတွေရဲ့(80%)ကျော်ဟာဒီလို(ER Positive)ကင်ဆာဆဲလ်အမျိုးအစားတွေဖြစ်ပြီး၊အခြားသောအက်စထဂိုဂျင်မလိုပဲနဲ့လဲပွားများနိုင်တဲ့(ER negative)ကင်ဆာဆဲလ်တွေကတော့(၂၀%)လောက်ပဲဖြစ်လေ့ဖြစ်ထရှိပါတယ်။
————————-
ဒီလိုဟော်မုန်းဓါတ်နဲ့ဆက်စပ်နေတဲ့မျိုးပွားအင်္ဂါတွေမှာဖြစ်ပေါ်လာတဲ့ကင်ဆာရောဂါတွေဟာ့မမျိုးဥအိမ်ကလစဉ်သဘာဝအားဖြင်ထုတ်လုပ်ပေးနေတဲ့အက်စထိုဂျင်ဟော်မုန်းတွေကနေစပြီးဖြစ်လာတာတော့မဟုတ်ပါဘူး။ဒါပေမဲ့ပြင်ပကလာတဲ့ဆင်တက်တစ်ဇီနိုအက်စထိုဂျင်(synthetic xenoestrogens) လို့ခေါ်တဲ့ဓါတုဗေဓဓါတ်ပေါင်းအက်စထရိုဂျင်အတုတွေကြောင့်စပြီးတော့ကင်ဆာတွေဖြစ်ပေါ်လာပါတယ်။ ပိုပြီးဆိုးတာကဆေးရုံဆေးခန်းတွေမှာဆရာဝန်တွေကသွေးဆုံးနေတဲ့အမျိုးသမီးတွေကိုသွေးဆုံးတဲ့ရောဂါဝေဒနာမျိုးမခံရအောင်ကုသပေးတဲ့(Hormone replacement Therapy =HRT)ဆေးဝါးတွေမှာပါတဲ့လူလုပ်တဲ့ဆင်တက်တစ်အက်စထရိုဂျင်(synthetic estrogens)ပါပဲ။ဆရာဝန်တွေဆေးရုံဆေးခန်းတွေမှာသုံးတဲ့သဘာဝမဟုတ်ပဲဓါတ်ခွဲခန်းမှာဓါတုဗေဒပစ္စည်းတွေသုံးပြီးအရင်းရှင်ဆေးကုမ္မဏီကြီးတွေကဖန်တီးထားတဲ့ဆေးဝါးတွေမှာပါတဲ့အက်စထရိုဂျင်ကတော့အပြင်းထန်ဆုံးနဲ့အဆိုးဆုံးဖြစ်လို့ရေရှည်သုံးရင်သေချာပေါက်ကင်ဆာရောဂါအစပြုဖြစ်ပွားစေနိုင်သလိုဖြစ်ပြီးသားကင်ဆာရောဂါတွေကိုလဲအကြီးအကျယ်ပွားများပြန့်ပွားစေနိုင်ပါတယ်။နောက်ဆိုးတာတစ်ခုကကင်ဆာဆဲလ်တွေဖြစ်သွားပြီဆိုရင်တော့မျိုးရိုးဗီဇပြောင်းလဲသွားပြီးမမျိုးဥအိမ်ကနေလစဉ်သဘာဝအားဖြင်ထုတ်လုပ်ပေးနေတဲ့သဘာဝအက်စထိုဂျင်ဟော်မုန်းတွေနဲ့တွေ့ရင်တောင်ထိုကင်ဆာဆဲလ်တွေဟာဆတိုးပြီးအကြီးအကျယ်ပွားများတော့တာပါပဲ။
———————-
ဆေးရုံဆေးခန်းတွေမှာဆရာဝန်တွေကသွေးဆုံးနေတဲ့သဘာဝမဟုတ်ပဲလူလုပ်ထားတဲ့ဆင်တက်တစ်အက်စထရိုဂျင်(synthetic estrogens)တွေကကိုယ်ကနားလည်လို့မသုံးဘူးဆိုရင်ရှောင်လို့ရပါသေးတယ်။ပြင်ပပါတ်ဝန်းကျင်ကလာတဲ့ဇီနိုအက်စထရိုဂျင်ကြတော့ဘယ်မှာတွေရှိနေသလဲဆိုတာကိုယ်ကသေသေချာချာသိမှကိုဖြစ်မှာဘာကြောင့်လဲဆိုတော့အဲဒီဇီနိုအက်စထိုဂျင်ဓါတ်တွေနဲ့များများထိတွေ့လေလေကင်ဆာဖြစ်နိုင်ခြေပိုများလေလေဖြစ်နေလို့ပါပဲ။ဇီနိုအက်စထိုဂျင်ဓါတ်တွေနဲ့များများထိတွေ့ဖန်များလာရင်အနေးနဲ့အမြန်သာကွာမယ်၊ကင်ဆာရောဂါတခုခုကတော့မကြာခင်ဖြစ်လာဖို့အတော်လေးကိုသေချာနေပါတယ်။ဒီလိုဇီနိုအက်စထိုဂျင်ဓါတ်တွေနဲ့မထိမိအောင်၊မိမိကိုယ်တွင်းကိုဒီဓါတ်တွေဝင်ရောက်မလာနိုင်အောင်ကာကွယ်ဖို့ကအရေးတကြီးလိုနေပြီဆိုတော့ဘယ်ပစ္စည်းတွေမှာဒီဇီနိုအက်စထိုဂျင်ဓါတ်တွေပါဝင်နေတယ်ဆိုတာကိုအဓိကလေ့လာဖို့လိုအပ်နေပါပြီ။ဒါမှသူတို့နဲ့မထိတွေ့မိအောင်ရှောင်နိုင်မှာမဟုတ်လား။
————
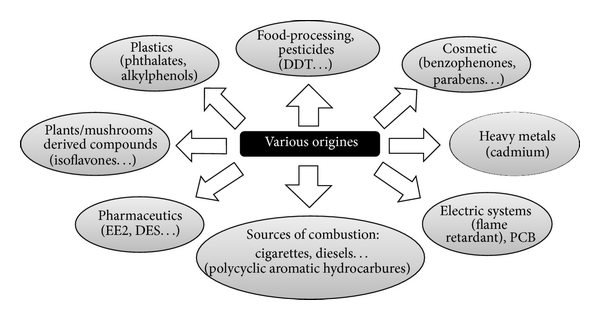
မနက်မိုးလင်းအိပ်ရာကထလိုက်ပြီဆိုတာနဲ့သွားတိုက်ဖို့သွားတိုက်တံနဲ့သွားတိုက်ဆေးလေးကိုစပြီးဆွဲယူလိုက်တာနဲ့၊အဲဒီမောင်မင်းကြီးသားဇီနိုအက်စထိုဂျင်နဲ့စတွေ့တော့တာပါပဲ။သွားတိုက်တံကကော်၊ပလတ်စတစ်နဲ့လုပ်ထားတော့ဇီနိုအက်စထိုဂျင်ပါနေတယ်။သွားတိုက်ဆေးကလဲဓါတုဗေဓပစ္စည်းတွေပါတော့ဇီနိုအက်စထိုဂျင်ကမလွတ်ပြန်ဘူး။မျက်နာသစ်မယ်လုပ်တော့လဲဆပ်ပြာမှာကဇီနိုအက်စထိုဂျင်၊ရေသုံးမယ်လုပ်တော့လဲရေပိုက်ခေါင်းကလာတဲ့ရေကလဲပလတ်စတစ်ပိုက်၊ကော်ပိုက်တွေသုံးထားလို့ဇီနိုအက်စထိုဂျင်ပါနေပြန်တယ်။စည်ပင်ရေသန့််စင်ရေးဌာနကလဲခြင်တွေပိုးလောက်လှမ်းတွေမဖြစ်ရအောင်ရေဖြန့်ဝေတဲ့ရေကန်မှာပိုးသတ်ဆေး(DDT)တွေဖြန်းထားတော့ဇီနိုအက်စထိုဂျင်ကပါနေပြန်ပါလေရော။မထူးပါဘူးမျက်နာလဲမသစ်တော့ဘူးရေခဲသေတ္တာထဲမှာပဲတခုခုသွားစားတော့မယ်ဆိုပြီးရေခဲသေတ္တာလက်ကိုင်ကိုကိုင်ဖွင့်လိုက်တော့အဲဒီပလတ်စတစ်လက်ကိုင်ကလဲဇီနိုမလွတ်ပြန်ဘူး။ရေခဲသေတ္တာမှာသုတ်ထားတဲ့ဆေးကလဲဓါတုပေဒဆေးတွေဖြစ်လို့ဇီနိုနဲ့မလွတ်ပြန်ဘူး။ရေခဲသေတ္တာထဲမှာအသီးအနှံတွေယူစားမယ်လုပ်တော့လဲစိုက်ပျိုးတုန်းကဓါတ်မြေသြဇာတွေပိုးသတ်ဆေးတွေသုံးထားတော့ကိုဇီနိုကမလွတ်ပြန်ဘူး။မထူးပါဘူးသောက်ရေသန့်ပဲသောက်တော့မယ်ဆိုပြီးတော့ပုလင်းလေးဆွဲထုတ်လိုက်တော့ပလတ်စတစ်ပုလင်းဖြစ်နေပြန်တယ်ဆိုတော့သူလဲမလွတ်ပြန်ဘူး။ဖန်ပုလင်းနဲ့လာတဲ့အချိုရေပဲသောက်တော့မယ်ဆိုပြီးဖန်ပုလင်းဆွဲထုတ်လိုက်တော့ဓါတုဗေဒဆိုးဆေးတွေဆိုးထားတော့မလွတ်ပြန်ဘူး။မထူးပါဘူးရေနွေးပဲတည်သောက်တော့မယ်ဆိုပြီးတော့လျှပ်စစ်ရေနွေးခရားကိုကောက်ကိုင်လိုက်တော့သူကလဲပလပ်စတစ်ဖြစ်နေပြန်တယ်။ရေနွေးခရားကစတီးဆိုရင်တောင်အဖုံးကပလပ်စတစ်ဖြစ်နေတယ်ဆိုတော့ဇီနိုကမလွတ်ပြန်ဘူး။ဘာမှလဲစားမနေသောက်မနေတော့ပါဘူး၊လေကောင်းလေသန့်လေးပဲရှုတော့မယ်ဆိုပြီးပြတင်းပေါက်ဖွင့်လိုက်တော့လေနဲ့အတူအရင်ဝင်လာတာကတော့လဲဇီနို၊မြို့ထဲမှာကားတွေမောင်းသွားတော့ကားအင်ဂျင်အိတ်ဇောကထွက်တဲ့ဇီနိုတွေလေထဲမှာလဲပြည့်နေပါလေ။အိမ်ထဲမှာလဲနံရံတွေမှာသုတ်ထားတဲ့ဆေးတွေကဇီနိုမလွတ်ပြန်ဘူး။ကားထဲမှာပဲသွားနေတော့မယ်ဆိုပြီးကားတံကားဖွင့်ဝင်လိုက်တော့ကားထဲကဒက်စ်ဘုတ်ကလဲဇီနိုမလွတ်ပြန်ဘူး။မထူးပါဘူးအိပ်ရာထဲဝင်ပြီးပြန်အိပ်တော့မယ်လုပ်တော့လဲ၊ခေါင်းဦးတွေစောင်တွေ၊ခြင်ထောင်တွေကဆပ်ပြာသုံးပြီးလျှော်ထားရလို့ဆပ်ပြာတွေအမွေးအကြိုင်တွေကနေလာတဲ့ဇီနိုတွေကကျန်နေပြန်ရော။အလှပဲပြင်တော့မယ်ဆိုပြီးကော်စမက်တစ်တွေမိတ်ကပ်တွေရေမွေးတွေလိမ်းမယ်ကြံလိုက်ရင်လဲအားလုံးမှာဇီနိုကပါနေပြန်ရော။မထူးပါဘူးဘုရားစင်ရှေ့သွားပြီးပုတီးပဲစိတ်တော့မယ်ဆိုပြီးတော့ပုတီးကောက်ကိုင်လိုက်တော့လဲပုတီးမှာအရောင်တင်ထားတဲ့ပေါလစ်ဆေးတွေကဇီနိုမလွတ်ပြန်ပါဘူး။
————–
ရှင်းရှင်းပြောရရင်တော့ခေါင်းပေါ်မှာလိမ်းထားတဲ့ခေါင်းလိမ်းဆီကနေပြီးတော့ခြေဖဝါးမှာစီးတဲ့ဖိနပ်အထိဆံပင်ဖျားကနေခြေဖျားအဆုံးသုံးလို့ရတဲ့ပစ္စည်းတွေထဲမှာဇီနိုအက်စထိုဂျင်နဲ့လွတ်တာဆိုလို့တခုမှကိုမရှိပါဘူး။အိမ်မှာဆိုရင်လဲကြမ်းမှာခင်းထားတဲ့ကြမ်းခင်းကအစပြုလို့ခေါင်မိုးမျက်နာကျက်မှာသုတ်ထားတဲ့သုတ်ဆေးအထိဆောက်လုပ်ရေးပစ္စည်းတွေအားလုံးမှာဇီနိုအက်စထရိုဂျင်(xenoestrogens)နဲ့လွတ်တာဘာမှကိုမရှိပါဘူး။ဇီနိုအက်စထရိုဂျင်နဲ့လွတ်ချင်ရင်တော့တနည်းပဲရှိတယ်၊လူမနှီးသူမနှီးဟိမဝန္တာတောတောင်တွေထဲသွားပြီးသစ်ရွက်မိုးကျောင်းလေးဆောက်ပြီးတယောက်ထဲနေမှပဲရတော့မယ်။ဒီခေတ်မှာဇီနိုအက်စထိုဂျင်နဲ့လွတ်တာဆိုလို့ဘာမှကိုမရှိတော့တာ။ကြာလေပိုဆိုးလေပိုမလွတ်လေပါပဲ။ပါတ်ဝန်းကျင်လေထုကလဲကြာလေညစ်ညမ်းလေ၊ဇီနိုပါဝင်မှုပိုများလာလေ။အမေရိကန်မှာဆိုရင်ဒီဇီနိုအက်စထိုဂျင်ကြောင့်အရွယ်မရောက်သေးတဲ့ခြောက်နှစ်လောက်ပဲရှိတဲ့ကလေးမလေးအချို့တွေတောင်မိန်းမအင်္ဂါအစိတ်အပိုင်းတွေကြီးထွားဖွံ့ဖြိုးလာပြီးငယ်ငယ်ရွယ်ရွယ်နဲ့ဓမ္မတာတွေစပြီးလာတဲ့ရောဂါတွေဖြစ်နေကြပြီ။စက်ရုံအလုပ်ရုံတွေနဲ့နီးတဲ့မြစ်တွေချောင်းတွေမှာငါးတွေပုဇွန်တွေဆိုရင်ဇီနိုအသ်စထရိုဂျင်ကြောင့်အထီးတွေပျောက်ပြီးအမတွေအဖြစ်ဘဝပြောင်းလဲသွားကြပါပြီ။ဒီခေတ်ကြီးမှာအဲဒီကင်ဆာဖြစ်စေတဲ့ဇီနိုအက်စထိုဂျင်ကိုရှောင်ဖို့ဆိုတာကတော့လုံးဝကိုမဖြစ်နိုင်တော့တာပါ။ဒါကြောင့်ဒီဟော်မုန်းနဲ့ပါတ်သက်တဲ့ကင်ဆာရောဂါတွေဟာလာမယ့်ဆယ်စုနှစ်တွေမှာလူတိုင်းနီးပါးဖြစ်လာလိမ့်မယ်လို့ကြိုတင်ပြီးအတိအကျသေချာပြောလို့ရတာပေါ့။တချို့ကဇီနိုကိုကြောက်လို့ရိုးရိုးပလတ်စတစ်ကိုမသုံးတော့ပဲ(BPA Free)ပလတ်စတစ်ဆိုပြီးဝယ်သုံးကြတယ်။ဒါပေမဲ့သိပ်တောမထူးပါဘူး(BPA Free)ခွက်နဲ့ရေထည့်သောက်လဲတခြားနေရာတွေကနေဇီနိုနဲ့တွေ့နေရဦးမှာပါပဲ၊အရှင်းကြီးတော့ဘယ်လိုမှမလွတ်နိုင်ပါဘူး။ဒီတော့ဒီကင်ဆာရောဂါတွေမဖြစ်ရအောင်ဘယ်လိုရှောင်ရမှာလဲ။ဒီဇီနိုကိုအလုပ်မလုပ်နိုင်အောင်ဘာလုပ်ရမလဲဆိုတာကိုသုသေသနတွေလုပ်ဖို့လိုလာပါပြီ။ဘာလုပ်ရမယ်ဆိုတာကိုတတိယပိုင်းတွင်ဆက်ရေးပေးပါမည်။အခုတော့နားပါဦးမည်။
——-
မှတ်ချက်။ဒီပို့စ်မှာရေးထားတဲ့အလွန်ဆိုးရွားတဲ့မဟော်မုန်းနဲ့အလားသဏ္ဍန်တူပြီးအကြီးအကျယ်ဒုက္ခပေးနိုင်တဲ့ပါတ်ဝန်းကျင်ပြင်ပကလာတဲ့ဇီနိုအက်စထရိုဂျင်ဆိုတာလူလုပ်တဲ့ဓါတုပစ္စည်းတွေကလာတဲ့ဆင်တက်တစ်ဇီနိုအက်စထိုဂျင်(synthetic xenoestrogens)ကိုသာဆိုလိုခြင်းဖြစ်ပြီး၊မိခင်သဘာဝကလာတဲ့(Natural Xenoestrogen)ဖြစ်တဲ့လူ့ကောင်းကျိုးပြု(Phytoestrogens)တွေကိုဆိုလိုထားခြင်းမဟုတ်ပါ။
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6104637/
———
—————References————-
Pritchard-Jones K, Kaatsch P, Steliarova-Foucher E, Stiller CA, Coebergh JWW. Cancer in children and adolescence in Europe: developments over 20 years and future challenges. European J Cancer. 2006;42:2183–2190. [PubMed] [Google Scholar]
Ferlay J, Autier P, Boniol M, Heaune M, Colombet M, Boyle P. Estimates of the incidence and mortality in Europe in 2. Annals of Oncology. 2007;18:581–592. [PubMed] [Google Scholar]
Moss RL, Gu O, Wong M. Estrogen: nontranscriptional signaling pathway. Recent Prog Horm Res. 1997;52:33–68. [PubMed] [Google Scholar]
Wooley CS. Acute effects of estrogen on neuronal physiology. Ann RevPharmacol Toxicol. 2007;47:657–80. [PubMed] [Google Scholar]
Fucic A, Miškov S, Zeljezic D, Bogdanovic N, Katic J, Gjergja R, Karelson E, Gamulin M. Is the role of estrogens and estrogen receptors in epilepsy still underestimated? Medical Hypotheses. 2009;73:703–705. [PubMed] [Google Scholar]
Chen GC, Zeng Q, Tse GMK. Estrogen and its receptors in cancer. Med Res Review. 2008;28(6):954–974. [PubMed] [Google Scholar]
Gonzales RJ, Ansar S, Duckles SP, Krause DN. Androgenic/estrogenic balance in the male rat cerebral circulation: metabolic enzymes and sex steroid receptors. J Cereb Blood Flow Metab. 2007;27(11):1841–1852. [PMC free article] [PubMed] [Google Scholar]
Lemmen JG, Arends RJ, van Boxtel AL, van der Saag PT, van der Burg B. Tissue and time dependent estrogen receptor activation in estrogen reporter mice. J Mol Endocrinol. 2004;32:689–701. [PubMed] [Google Scholar]
Roy D, Liehr JG. Estrogen DNA damage and mutations. Mutat Res. 1999;424:107–115. [PubMed] [Google Scholar]
Knapczyk K, Duda M, Szafranska B, Wolsza K, Panasiewicz G, Koziorowski M, Slomczynska M. Immunolocaliosation of oestrogen receptors alpha (Eralpha) and beta (Erbeta) in porcine embryos and fetuses at different stages of gestation. Acta Vet Hung. 2008;56(2):221–233. [PubMed] [Google Scholar]
Branderberger AW, Tee MK, Lee JY, Chao V, Jaffe RB. Tissue distribution of estrogen receptors alpha (Er?) and beta (Erβ) mRNA in the midgestational human fetus. J Clin Endocrinol & Metabolism. 1997;82(10):3509–3512. [PubMed] [Google Scholar]
Paruthiyil S, Parmar H, Kerekatte V, Cunha GR, Firestone GL, Leitman DC. Estrogen receptor beta inhibits human breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest. Cancer Res. 2004;64(1):423–428. [PubMed] [Google Scholar]
Grabinski JL, Chisholm G, Smith LS, Drengler RL, Kalter S, Rodriguez G, Garner A, Cooper J, Pollock B, Kuhn J. ER alpha genotypes and breast cancer. J Clin Oncol. 2008;26(15S):501. [Google Scholar]
Hall JM, Korach KS. Analysis of the molecular mechanisms of human estrogen receptors alpha and beta reveals differential specificity in taret promotor regulation by xenoestrogens. J Biol Chem. 2002;277(46):44455–44461. [PubMed] [Google Scholar]
Cavalieri EL, Stack DE, Devanesan PD. Molecular origin of cancer: catechol estrogen-3,4-quinones as endogenous tumor initiators. Proc Nat Acad Sci USA. 1997;94:10937–10942. [PMC free article] [PubMed] [Google Scholar]
Roy D, Cai Q, Felty Q, Narayan S. Estrogen-induced generation of reactive oxygen and nitrogen species, gene damage and estrogen dependent cancers. J Toxicol Environ Health, Part B. 2007;10(4):235–257. [PubMed] [Google Scholar]
Dubrova YE, Ploshchanskaya OG, Kozionova OS, Akleyev AV. Minisatellite germline mutation rate in the Techa River population. Mutat Res. 2006;602(1-2):74–82. [PubMed] [Google Scholar]
Kaup S, Grandjean V, Mukherjee R, Kapoor A, Keyes E, Seymour CB, Mothersill CE, Schofield PN. Radiation-induced genomic instability is associated with DNA methylation changes in cultured human keratinocytes. Mutat Res. 2006;597(1-2):87–97. [PubMed] [Google Scholar]
Liehr JG. Genotoxicity of the steroidal oestrogens oestrone and oestradiol:possible mechanism of uterine and mammary cancer development. Hum Reprod Update. 2001;7(3):273–281. [PubMed] [Google Scholar]
Ansell PJ, Espinosa-Nicholas C, Curran EM, Judy BM, Philips BJ, Hannink M, Lubahn DB. In vitro and in vivo regulation of antioxidant response element-dependent gene expression by estrogens. Endocrinology. 2004;145(1):311–7. [PubMed] [Google Scholar]
Arbuckle TE. Are there sex and gender differences in acute exposure to cheicals n the same setting? Environ Res. 2006;101:195–204. [PubMed] [Google Scholar]
Alworth LC, Howdesshell KL, Ruhlen RL, Day JK, Lubahn DB, Huang HM, Besch-Williford CL, Saal FS. Uterine responsiveness to estradiol and DNA methylation are altered by fetal exposure to diethylstilbestrol and methychlor in CD-1 M, Effects of low versus high doses. Toxicol Appl Pharmacol. 2002;183:10–22. [PubMed] [Google Scholar]
Rosenthal MD, Albrecht ED, Pepe GJ. Estrogen modulates developmentaly regulated gene expression in the fetal baboon liver. Endocrine. 2004;23(2-3):219–228. [PubMed] [Google Scholar]
Darbre PD. Environmental oestrogens, cosmetics and breast cancer. Best Practice & Research. Clin Endocrinol & Metabolism. 2006;20(1):121–143. [PubMed] [Google Scholar]
Barbieri RL, Gochberg J, Ryan KJ. Nicotine, cotinine, and anabasine inhibit aromatase in human trophoblast in vitro. J Clin Invest. 1986;77(6):1727–1733. [PMC free article] [PubMed] [Google Scholar]
Wang SL, Chang YC, Chao HR, Li CM, Li LA, Lin LY, Papke O. Body burdens of polychlorinated dibenzo-p-dioxins, dibenzofurans, and biphenyls and their relations to estrogen metabolism in pregnant women. EHP. 2006;114(5):740–745. [PMC free article] [PubMed] [Google Scholar]
Hsieh M, Grantha E, Liu B, Macapagai R, Willingham E, Baskin LS. In utero exposure to benzophenone-2 causes hypospadias through an estrogen receptor dependent mechanisms. J Urol. 2007;178:1637–1642. [PubMed] [Google Scholar]
Birnbaum LS, Fenton S. Cancer and developmental exposure to endocrine disruptors. EHP. 2003;111(4):389–394. [PMC free article] [PubMed] [Google Scholar]
Andersen HR, Bonefeld-Jorgensen EC, Nielsen F, Jarfeldt K, Jayatissa MN, Vinggaard AM. Estrogen effects in vitro and in vivo of the fungicide fenarimol. Toxicol Lett. 2006;163(2):142–152. [PubMed] [Google Scholar]
Hery C, Ferlay J, Boniol M, Autier P. Changes in breast cancer incidence and mortlaity in middle-aged and elderly women in 28 countries with Causcasian mjaroty populations. Annals of Oncology. 2008;19:1009–1018. [PubMed] [Google Scholar]
Kovalchuk O, Tryndiyak P, Montgomery B, Boyko A, Kutanzi K, Zemp F, Warbritton AR, Latendresse JR, Kovalchuk I, Beland FA, Pogrybny IP. Estrogen-induced at breast carcinogenesis is characterized by alterations in DNA methylation, histone modifications and aberrant microRNA expression. Cell Cycle. 2007;6(16):2010–8. [PubMed] [Google Scholar]
Feigelson HS, Henderson BE. Estrogens and breast cancer. Carcinogenesis. 1996;17(11):2279–84. [PubMed] [Google Scholar]
Bernstein JL, Langholz B, Haile RW, Bernstein L, Thomas DC, Stovall M, Malone KE, Lynch CF, Olsen JH, Anton-Culver H, Shore RE, Boice JD, Berkowitz GS, Gatti RA, Teitelbaum SL, Smith SA, Rosenstien BS, Borresen-Dale AL, Concannon P, Thompson WD. Study design:evaluating gene-environment interactions in the etiology of breast cancer- the WECARE study. Breast Cancer Res. 2004;6:199–214. [PMC free article] [PubMed] [Google Scholar]
Mitra AK, Faruque FS, Avis AL. Breast cancer and environmental risks: where is the link? J Environ Health. 2004;66(7):24–32. [PubMed] [Google Scholar]
Zhang Y, Wise JP, Holford TR, Xie H, Boyle P, Hoar Zahm SH, Rusiecki J, Zou K, Zhang B, Zhu Y, Owens PH, Zheng T. Serum polychlorinated biphenyls P-450 1A1 polymorphisms, and risk of breast cancer in Connecticut women. Am J Epidemiol. 2004;160:1177–1183. [PubMed] [Google Scholar]
Nie J, Beyea J, Bonner MR, Han D, Vena JE, Rogerson P, Vito D, Muti P, Trevisan M, Edge SB, Freudenheim JL. Exposure to traffic emissions through life and risk of breast cancer: the western New Your exposure and breast cancer (WEB) study. Cancer Causes & Control. 2007;18(9):947–955. [PubMed] [Google Scholar]
Hilakivi-Clarke L, Cabanes A, de Assis S, Wang M, Khan G, Shoemaker WJ, Stevens RG. In utero alcohol exposure increases mammary tumorigenesis in rats. Brit J Cancer. 2004;90:2225–2231. [PMC free article] [PubMed] [Google Scholar]
Warri A, Saarinen NM, Makela S, Hilakivi-Clarke L. The role of early life genistein exposures in modifying breast cancer risk. BJC. 2008;98:1485–1493. [PMC free article] [PubMed] [Google Scholar]
Baik I, Becker PS, DeVito WJ, Lagiou P, Ballen K, Quesenberry PJ, Hsieh P. Stem cells and prenatal origin of breast cancer. Cancer Causes and Control. 2004;15:517–530. [PubMed] [Google Scholar]
Brody JG, Rudel RA. Environmental pollutants and breast cancer. EHP. 2003;111(8):1007–19. [PMC free article] [PubMed] [Google Scholar]
Brody JG, Aschengrau A, McKelvey W, Swartz CH, Kennedy T, Rudel RA. Breast cancer risk and drinking water contaminated by wastewater: a case control study. Environ Health. 2006;6:5–28. [PMC free article] [PubMed] [Google Scholar]
Brody JG, Rudel RA, Michels KB, Moysich KB, Bernstein L, Attfiled KR, Gray S. Environmental pollutants, diet, physical activity, body size and breast cancer. Cancer (Suppl) 2007;109(12):2627–2634. [PubMed] [Google Scholar]
Coutelle C, Hohn B, Benesova M, Oneta CM, Quattrochi P, Roth HJ, Schmidt-Gayk H, Schneeweiss A, Bastert G, Seitz HK. Risk factor in alcohol associated breast cancer: Alcohol dehydrogenase polymorphism and estrogens. Int J Oncology. 2004;25(4):1127–1132. [PubMed] [Google Scholar]
Fan S, Meng Q, Gao B, Grossman J, Yadegari M, Goldberg ID, Rosen EM. Alcohol stimulates estrogen receptor signaling in human breast cancer cell lines. Cancer Res. 2000;60:5635–5639. [PubMed] [Google Scholar]
Li XM, Ganmma D, Sato A. The experience of Japan as a clue to the etiology of breast and ovarian cancers: relatioship between death from both malignancies and dietary practices. Med Hypothesis. 2003;60(2):268–275. [PubMed] [Google Scholar]
Ganmaa D, Sato A. The possible role of female sex hormones in milk from cows in the development of breast, ovarian and corpus uteri cancers. Medical Hypothesis. 2005;65:1028–1037. [PubMed] [Google Scholar]
Ganmaa D, Wang PY, Qin LQ, Hoshi K, Sato A. Is milk repossible for male reproductive disorders. Med Hypothesis. 2001;57:510–514. [PubMed] [Google Scholar]
Bennion BJ, Cosman M, Lightstone FC, Knize MG, Montgomery JL, Bennett LM, Felton JS, Kulp KS. PhIP carcinogenicity in breast cancer: computational and experimental evidence for competitive interactions with human estrogen receptor. Chem Res Toxicol. 2005;18:1528–1536. [PubMed] [Google Scholar]
Lauber SN, Gooderham NJ. The cooked meat-derived genotoxic carcinogen 2-amino-3-methylimidazol (4,5-b) pyridine has potent hormone-like activity: mechanistic support for a role in breast cancer. Cancer Res. 2007;67:9597–9602. [PubMed] [Google Scholar]
Ito N, Hasegawa R, Sano M, Tamano S, Esumi H, Takayama S, Sugimura T. A new colon and mammary carcinogen in cooked food 2-amino-1-methyl-6-phenylimidazo (4,5b)pyridine (PhIP) Carcinogenesis. 1991;12:1503–1506. [PubMed] [Google Scholar]
Snyderwine EG. Mammary gland carcinogenesis by 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine in rats: possible mechanisms. Cancer Lett. 1999;143(2):211–5. [PubMed] [Google Scholar]
Bonner MR, Han D, Nie J, Rogerson P, Vena JE, Muti P, Trevisan M, Edge SB, Freudenheim JL. Breast cancer risk and exposure in early life to polycyclic aromatic hydrocarbons using total suspended particulates as a proxy measure. Cancer Epidemiol Biomarkers Prev. 2005;14(1):53–60. [PubMed] [Google Scholar]
Coyle YM, Hynan LS, Euhus DM, Minhajuddin ATM. An ecological study of the association of environmental chemicals on breast cancer incidence in Texas. Breast Cancer Res Treatment. 2005;92:107–114. [PubMed] [Google Scholar]
Ohayama K, Magai F, Tsuchiya Y. Certain styrene oligomers have proliferative activity on MCF-7 cells and binding affinity for human estrogen receptor alpha. EHP. 2001;109:699–703. [PMC free article] [PubMed] [Google Scholar]
Ohyama KI, Satoh K, Sakamoto Y, Ogata A, Nagai F. Effects of prenatal exposure to styrene trimers on genital organs and hormones in male rats. Exp Biol Med. 2007;232(2):301–308. [PubMed] [Google Scholar]
Kitamura S, Ohmegi M, Sanoh S, Sugihara K, Yoshihara S, Fujimoto N, Ohta S. Estrogenic activity of styrene oligomers after metabolic activation by rat liver microsomes. EHP. pp. 329–334. [PMC free article] [PubMed]
Charlier CJ, Albert AI, Zhang L, Dubois NG, Plomteux GJ. Polychlorinated byphenyls contamination in women with breast cancer. Clin Chimaca Acta. 2004;347:177–181. [PubMed] [Google Scholar]
Moysich KB, Menezes RJ, Baker JA, Falkner KL. Environmental exposure to plychlorinated biphenyls and breast cancer risk. Rev Environ Health. 2002;17(4):263–277. [PubMed] [Google Scholar]
Boffetta P. Human cancer from environmental pollutants: the epidemiological evidence. Mutat Res. 2006;608:157–162. [PubMed] [Google Scholar]
Stabile LP, Davis AL, Gubish CT, Hopkins TM, Luketich JD, Christie N. Human non-small cell lung tumors and cells derived from normal lung express both estrogen receptor alpha and beta and show biological response to estrogen. Cancer Res. 2002;62:2141–2150. [PubMed] [Google Scholar]
Fasco MJ, Hurteau GJ, Spivack SD. Gender dependent expression of alpha and beta estrogen receptors in human nontumor and tumor lung tissue. Mol Cell Endocrinol. 2002;188(1-2):125–140. [PubMed] [Google Scholar]
Stabile LP, Siefried JM. Sex and gender differences in lung cancer. J Gend Specif Med. 2003;6(1):37–48. [PubMed] [Google Scholar]
Rivera MP. Lung cancer in women: the difference in epidemiology, biology and treatment outcomes. Expert Rev Resp Med. 2009;3(6):627–634. [PubMed] [Google Scholar]
Olak J, Colson Y. Gender differences in lung cancer: have we really come a long way, baby? J Thorac Cardiovasc Surg. 2004;128:346–351. [PubMed] [Google Scholar]
Jemal A, Siegel R, Ward E. Cancer Statistics. Cancer J Clin. 2006;56:106. [PubMed] [Google Scholar]
Vineis P, Forastiere F, Hoek G, Lipsett M. Outdoor air pollution and cancer: recent epidemiologic evidence. Int J Cancer. 2004;111:647–652. [PubMed] [Google Scholar]
Whitrow MJ, Smith BJ, Pilotto LS, Pisaniello D, Nitschke M. Environmental exposure to carcinogens causinglung cancer: epidemiological evidence from the medical literature. Respirology. 2003;8:513–521. [PubMed] [Google Scholar]
Yang CY, Chiu HF, Chiu JF, Kao WY, Tsai SS, Lan SJ. Cancer mortality and residence near petrochemical industries in Taiwan. J Toxicol Environ Health. 1997;50:265–273. [PubMed] [Google Scholar]
Majidi M, Al-Wadel HA, Takahashi T, Schuller HM. Nongenomic beta estrogen receptor enchance beta1 adrenergic signaling induced by the nicotine-derived carcinogen 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone in human small airway epithelial cells. Cancer Res. 2007;67:6863–6874. [PubMed] [Google Scholar]
Zhao Y, Wang S, Aunan K, Seip HM, Hao J. Air pollution and lung cancer risks in China- a meta-analysis. Sci Total Environ. 2006;366:500–513. [PubMed] [Google Scholar]
Ramanakumar AV, Parent ME, Siemiatycki J. Risk of lung cancer from residential heating and cooking fuels in Montreal, Canada. Am J Epidemiol. 2007;165:634–642. [PubMed] [Google Scholar]
Schwartz AG, Prysak GM, Murphy V, Lonardo F, Pass H, Schwartz J, Brooks S. Nuclear estrogen receptorbeta in lung cancer: expression and survival differences by sex. Imaging, Diagnosis, Prognosis. 2005;11(20):7280–7287. [PubMed] [Google Scholar]
Skov BG, Fischer BM, Pappot H. Oestrogen receptor beta over expression in males with non-small cell cancer is associated with beter survival. Lung Cancer. 2008;59(1):88–94. [PubMed] [Google Scholar]
Xu R, Shu Y. Estrogen and its signaling pathway in non-small cell lung cancer (NSCLC) J Najing Med Univ. 2009;23(4):217–223. [Google Scholar]
Beyer C, Küppers E, Karolczak M, Trotter A. Ontogenetic expression of estrogen and progesterone receptors in the mouse lung. Biol Neonate. 2003;84(1):59–63. [PubMed] [Google Scholar]
Oyama T, Sugio K, Isse T, Matsumoto A, Uramoto NH, Nozoe T, Morita M, Kagawa N, Muto TM, Yasumoto K, Kawamoto T. Expression of cytochrome P450 in non-small lung cancer. Frontiers Biosci. 2008;13:5787–5793. [PubMed] [Google Scholar]
Slatore CG, Chien JW, Au DH, Satia JA, White E. Lung cancer and hormone replacement therapy:association in the vitamins and lifestyle study. J Clin Oncol. 2010;28(9):1540–1546. [PMC free article] [PubMed] [Google Scholar]
Matsuo K, Ito H, Yatabe Y, Hiraki A, Hirose K, Wakai K. Risk factors differ for non-small-cell lung cancer with and without EFGR mutation:assessment of smoking and sex by a case-control study in Japanese. Cancer Sci. 2007;98(1):96–101. [PubMed] [Google Scholar]
Samet JM. Environmental causes of lung cancer: what do we know in 2003? Chest. 2004;125:80–83. [PubMed] [Google Scholar]
Pauly JR, Slotkin TA. Maternal tobacco smoking, nicotine replacement and neurobeahavioural development. Acta Paediatrica. 2008;97(10):1331–1337. [PubMed] [Google Scholar]
Sarasin A, Schlumpf M, Muller M, Fleishmann I, Lauber ME, Lichtenstein. Adrenal-mediated rather than direct effects of nicotine as a basis of altered sex steroid synthesis in fetal and neonatal rat. Reprod Toxicol. 2003;17(2):153–162. [PubMed] [Google Scholar]
Muggi ME, Elbert JO, Robertson C, Hurt RD. Waking a sleeping ginat: the tobacco industry’s response to the Polonium-210 issue. Am J Pub Health. 2008;98(9):1643–1650. [PMC free article] [PubMed] [Google Scholar]
Raymond-Whish S, Mayer LP, O’Neal T, Martinez A, Sellers MA, Christian PJ, Marion SL, Begay C, Propper CR, Hoyer PB, Dyer CA. Drinking water with Uranium below the US EPA water standard causes estrogen receptor-dependent responses in female mice. EHP. 2007;115(12):1711–1716. [PMC free article] [PubMed] [Google Scholar]
Beelen R, Hoek G, van den Brandt PA, Goldbohm RA, Fischer P, Schouten LJ, Jerrett M, Hughes E, Armstrong B, Brunekreef B. Long-term effects of traffic-related air pollution on mortality in a Ducth cohort (NLCS-AIR Study) EHP. 2008;116(2):196–202. [PMC free article] [PubMed] [Google Scholar]
Laden F, Schwartz J, Speizer FE, Dockery DW. Reduction in fine particulate air pollution and mortality. Am J Respir Crit Care Med. 2006;173:667–672. [PMC free article] [PubMed] [Google Scholar]
Misaki K, Suzuki M, Nakamura M, Handa H, Iida M, Kato T, Matsui S, Matsuda T. Aryl hydrocarbon receptor and estrogen receptor ligand activity of organic exctracts from road dust and diesel exhaust particulates. Arch Environ Contam Toxicol. 2008;55:199–209. [PubMed] [Google Scholar]
Ssempebwa JC, Carpenter DO, Yilmaz B, DeCaprio AP, O’Hehir DJ, Arcaro KF. Waste crankcase oil: an environmental contaminant with potential to modulate estrogenic responses. J Toxicol Environ Health, Part A. 2004;67:1981–1094. [PubMed] [Google Scholar]
Van de Wiele T, Vanhaecke L, Boeckaert C, Peru K, Headly J, Verstraete W, Siciliano S. Human colon microbiota trasnform polycyclic aromatic hydrocarbons to estrogenic metablites. EHP. 2005;113:6–10. [PMC free article] [PubMed] [Google Scholar]
Klein GP, Hodge EM, Diamond ML, Yip A, Dann T, Stern G, Denison MS, Harper PA. Gas-Phase ambient air contaminants exhibit significant dioxin-like and estrogen-like activity in vitro. EHP. 2006;114(5):697–703. [PMC free article] [PubMed] [Google Scholar]
Cohen AJ. Outdoor air pollution and lung cancer. EHP. 2000;108:743–750. [PMC free article] [PubMed] [Google Scholar]
Parodi S, Baldi R, Benco C, Franchini M, Garrone E, Vercelli M, Pensa F, Puntoni R, Fontana V. Lung cancer mortality ina district of La Spezia (Italy) exposed to air pollution from industrial plants. Tumori. 2004;90:181–185. [PubMed] [Google Scholar]
Shen J, Liu J, Xie Y, Diwan BA, Waalkes MP. Fetal onset of aberrant gene expression relevant to pulmonary carcinogenesis in lung adenocarcinoma development induced by the utero arsenic exposure. Toxicol Sci. 2007;95(2):313–320. [PMC free article] [PubMed] [Google Scholar]
Tanaka Y, Sasaki M, Kaneuchi M, Fujimoto S, Dahiya R. Estrogen receptor alpha polymorhism and renal cell carcinoma- possible risk. Mol Cellular Endocrinol. 2003;202:109–116. [PubMed] [Google Scholar]
Moyad MA. Review of potential risk factors for kidney (renal cell) cancer. Semin Urol Oncol. 2001;19:280–293. [PubMed] [Google Scholar]
Ilyasova D, Schwartz GG. Cadmium and renal cancer. Toxicol Applied Pharmacol. 2005;207:179–186. [PubMed] [Google Scholar]
Hopenhayn-Rich C, Biggs ML, Smith AH. Lung and kidney cancer mortality associated with arsenic in drinking water in Cordoba, Argentina. Int J Epidemiol. 1998;27:561–569. [PubMed] [Google Scholar]
Søreide K, Aagnes B, Møller B, Westgaard A, Bray F. Epidemiology of pancreatic cancer in Norway: trends in incidence, basis of diagnosis and survival 1965-2007. Scand J Gastroenterol. 2010;45(1):82–92. [PubMed] [Google Scholar]
Luke C, Price T, Karapetis C, Singhai N, Roder D. Pancreatic cancer epidemiology and survival in an Australia population. Asian Pac J cancer Prev. 2009;10(3):369–374. [PubMed] [Google Scholar]
Hariharan D, Saied A, Kocher HM. Analysis of mortality rates for pancreatic cancer across the world. HPB (Oxford) 2008;10(1):58–62. [PMC free article] [PubMed] [Google Scholar]
Sauerland C, Engelking C, Wickham R, Pearlstone DB. Cancers of the pancreas and hepatobilliary system. Seminars in Oncol Nursing. 2009;25(1):76–92. [PubMed] [Google Scholar]
Lowenfels AB, Maisonneuve P. Epidemiology and risk factors for pancreatic cancer. Best Practice & Res Clin Gastroenteol. 2006;20(2):197–209. [PubMed] [Google Scholar]
Konduri S, Schwartz RE. Estrogen receptor beta/alfa ratio predicts response of pancreatic cancer cells to estrogens and phytoestrogens. J Surgical Res. 2007;140:55–66. [PubMed] [Google Scholar]
Andren-Sandberg A, Hoem D, Backman PL. Other risk factors for pancreatic cancer: hormonal aspects. Ann Oncol. 1999;10(Suppl 4):131–132. [PubMed] [Google Scholar]
Trushin N, Leder G, El Bayoumy K, Hoffmann D, Beger HG, Henne-Bruns D, Ramadani M, Prokopcyk B. The tobacco carcinogen NNK is stereoselectively reduced by human pancreatic microsomes and cytosols. Langenbecks Ach Surg. 2008;393:571–579. [PubMed] [Google Scholar]
Kummer V, Maskova J, Zraly Z, Matiasovic J, Faldyna M. Effect of postnatal exposure to benz(a)pyrene on the uterus of immature rats. Exp Toxicol Pathol. 2007;59(1):69–76. [PubMed] [Google Scholar]
Bogush TA, Dudko EA, Beme AA, Bogush EA, Polotskii BE, Tiuliandin SA, Davydov MI. Estrogen receptor expression in tumors different from breast cancer. Antibiot Khimioter. 2009;54(7-8):41–49. [PubMed] [Google Scholar]
Ben-Porath I, Thomson MW, Carey VJ, Ge R, Bell GW, Regev A, Weinberg RA. An embryonic stem cell-like gene expression signature in poorly differentiated aggressive human tumors. Nat Genet. 2008;40(5):499–507. [PMC free article] [PubMed] [Google Scholar]
Batistatou A, Kyzas PA, Goussia A, Arkoumani E, Voulgaris S, Polyzoidis K, Agnantis NJ, Stefanou D. Estrogen receptor beta (ERbeta) protein expression correlates with BAG-1 and prognosis in brain glial tumours. J Neurol. 2006;77(1):17–23. [PubMed] [Google Scholar]
Estrada M, Varshney A, Ehrilich BE. Elevated testosterone induces apoptosis in neuronal cells. Biol Chem. 2006;281(35):25492–25501. [PubMed] [Google Scholar]
Liu CC, Chen CC, Wu TN, Yang CY. Association of brain cancer with residential exposure to petrochemical air pollution in Taiwan. J Toxicol Environ Health, Part A. 2008;71:310–314. [PubMed] [Google Scholar]
Huyghe E, Plante P, Thonneau PF. Testicular cancer variations in time and sapce in Europe. Eur Urol. 2007;51:621–628. [PubMed] [Google Scholar]
Maffezzini M. TC incidence increasing: spread the word. European Urology. 2007;51:596–597. [PubMed] [Google Scholar]
Cavaco JE, Laurentino SS, Barros A, Sousa M, Socorro S. Estrogen receptors alpha and beta in human testis: both isoforms are expressed. Syst Biol Reprod Med. 2009;55(4):137–144. [PubMed] [Google Scholar]
Delbes G, Duquenne C, Szenker J, Taccon J, Habert R, Levacher C. Developmental changes in testicular sensitivity to estrogens through feral and neonatal life. Toxicol Sci. 2007;99(1):234–243. [PubMed] [Google Scholar]
Kaijser M, Akre O, Cnattinius S, Ekbom A. Maternal lung cancer and testicular cancer risk in the offspring. Cancer Epidemiol Biomarkers, Prevention. 2003;12:643–646. [PubMed] [Google Scholar]
Swerdlow AJ, Stiller CA, Wilson LM. Prenatal factors in the aetiology of testicular cancer: an epidemiological study of childhood testicular cancer deaths in Great Britain, 1953-73. J Epidemiol Community Health. 1982;36(2):96–101. [PMC free article] [PubMed] [Google Scholar]
Smith LM, Cloak CC, Poland RE, Torday J, Ross MG. Prenatal nicotine increase testosterone levels in the fetus and females offspring. Nicotine Tob Res. 2003;5(3):369–374. [PubMed] [Google Scholar]
Storgaard L, Bonde JP, Olsen J. Male reproductive disorders in humans and prenatal indicators of estrogen exposure. A review of published epidemiological studies. Reprod Toxicol. 2006;21(1):4–15. [PubMed] [Google Scholar]
McLachlan JA, Simpson E, Martin M. Endocrine disrupters and female reproductive health. Best Pract Res Clin Endocrinol Metab. 2006;20(1):63–75. [PubMed] [Google Scholar]
Drummond E, Fuller PJ. The importance of ERbeta signalling in the ovary. J Endocrinol. 2010;205(1):15–23. [PubMed] [Google Scholar]
Amram-Benamran ML, Cochet S, Petignat P, Sappino AP. Ovarian cancer screening: recommendations for clinical pratice. Rev Med Suisse. 2010;6(250):1066–1068. [PubMed] [Google Scholar]
Henson MC, Chedrese PJ. Endocrine disruption by cadmium, a common environmental toxicant with paradoxical effects on reproduction. Exp Biol Med. 2004;229:383–392. [PubMed] [Google Scholar]
Grant WB. An ecologic study of dietary and solar ultraviolet-B links to breast carcinoma mortality rate. Cancer. 2002;94(1):272–281. [PubMed] [Google Scholar]
El-Zein R, Conforti-Froes N, Au WW. Interactions between genetic predisposition and environmental toxicants for development of lung cancer. Environ Mol Mutagenesis. 1997;30:196–204. [PubMed] [Google Scholar]
Park SK, Yoo KY, Lee SJ, Kim SU, Ahn SH, Noh DY, Choe KJ, Strickland PT, Hirvonen A, Kang D. Alcohol consmtion, glutathione S-transferase M1 and T1 genetic polymorphysim and breast cancer risk. Pharmacogenetics. 2000;10:301–309. [PubMed] [Google Scholar]
Wadia PR, Vanderberg LN, Schaeberle CM, Rubin BS, Sonnenschein C, Soto AM. Perinatal bisphenol A exposure increases estrogen sensitivity of the mammary gland in diverse mouse strain. EHP. 2007;115(4):592–598. [PMC free article] [PubMed] [Google Scholar]
Prins GS, Tang WY, Belmonte J, Ho SM. Developmental exposure to bisphenol A increases prostate cancer susceptibility in adult rats: epdegenetic mode of action is implicated. Fertility and Strerility. 2008;89(Suppl 1):41–42. [PMC free article] [PubMed] [Google Scholar]
Miki Y, Suzuki T, Tazawa C, Blumberg B, Sasano H. Steroid and xenobiotic receptor (XR), cytochrome P450 3A4 and multidrug resistance gene 1 in human adult and fetal tissues. Mol Cellular Endocrinol. 2005;231:75–85. [PubMed] [Google Scholar]