Source from Kelvin A. Power’s Facebook on August 6, 2019
အရေးအကြီးဆုံးအချက်ကဆီးချိုရော(Type-2 Diabetes)အကြောင်းရေးနေတာပဲလေငါနဲ့မဆိုင်ပါဘူးဆိုပြီးတော့ကျော်မသွားမိပါစေနဲ့။မိမိမှာဆီးချိုရောဂါရှိရှိ၊မရှိရှိ၊လူ့ခန္ဓာကိုယ်ရှိနေသရွေ့၊ဒီဆောင်းပါးဟာလူတိုင်းနဲ့ဆိုင်သလို၊လူတိုင်းအတွက်တန်ဖိုးလဲရှိပါတယ်။ကျွန်တော်ကဆီးချိုရောဂါ(Type-2 Diabetes)လို့သာခေါင်းစဉ်တပ်ထားတာပါတကယ်တော့ဆီးချိုရောဂါအကြောင်းရေးနေတာတော့မဟုတ်ပါဘူး။ဘာကြောင့်လဲဆိုတော့ဆီးချိုတယ်၊သွေးချိုတယ်ဆိုတာကရောဂါမှမဟုတ်တာ။နောက်ကွယ်မှာဖြစ်နေတဲ့ရောဂါတစ်ခုကြောင့်ဆီးချိုတယ်၊သွေးချိုတယ်ဆိုတဲ့မြင်သာထင်ရှားတဲ့လက္ခဏာဖြစ်ပေါ်လာရတယ်တိုတာကိုအပိုင်း(၁)မှာလဲသေချာရှင်းပြပြီးသွားပါပြီ။ဘာကြောင့်ဒီလိုပြောရသလဲဆိုတော့ဆီးချိုအမျိုးအစား(၂)၊(Type-2 Diabetes)ကိုဖြစ်ပေါ်စေတဲ့မူရင်းအကြောင်းတရားဟာကမ္ဘာပေါ်မှာဖြစ်နေတဲ့နာတာရှည်ရောဂါအားလုံးနဲ့ဆက်စပ်တူညီနေလို့ပါပဲ။
——-
ဆီးချိုအမျိုးအစား(၂)ဆိုတာဟာနှလုံးရောဂါ၊အဆုတ်ရောဂါ၊ကျောက်ကပ်ရောဂါ၊နှလုံးသွေးကြောကျဉ်းရောဂါ၊လေဖြတ်ရောဂါ၊နာတာရှည်ရောဂါ၊(autoimmune)ရောဂါ၊ကင်ဆာရောဂါအစရှိတဲ့ရောဂါတွေနဲ့တိုက်ရိုက်ဆက်စပ်နေပြီးတော့ရောဂါအားလုံးရဲ့အစပျိုးရာမိခင်ကြီးဖြစ်နေလို့ပါပဲ။ဆီးချိုအမျိုးအစား(၂)ဖြစ်ပြီဆိုရင်ဒီမှာတင်ရပ်မနေပါဘူး။အနှေးတဲ့အမြန်ရှုပ်ထွေးမှု(Complication)ဆိုတာဖြစ်လာပြီးတော့တခြားရောဂါအမျိုးမျိုးတွေပါအလွယ်တကူဖြစ်လာတတ်ပါတယ်။ဘာကြောင့်လဲဆိုတော့ဒီရောဂါဖြစ်စေတဲ့အခြေခံအကြောင်းတရားကတခြားရောဂါတွေအားလုံးကိုဖြစ်စေတဲ့အခြေခံအကြောင်းတရားနဲ့တထပ်တည်းကျနေလို့ပါပဲ။
————
ကျွမ်းကျင်လိမ္မာသောလယ်သမားတစ်ယောက်ဟာကောက်ပင်တွေကိုရိတ်သိမ်းမယ်ဆိုရင်တပင်ချင်းလိုက်ပြီးမရိတ်သိမ်းနေပါဘူး။လက်တဖက်ကကောက်ပင်တွေအားလုံးကိုစုပြီးကျစ်ကျစ်ဆုတ်ကိုင်လိုက်ပြီးတော့ကျန်တဲ့လက်တဖက်ကတံစဉ်ကိုကိုင်ပြီးအကုန်လုံးကိုတစ်ချက်တည်းနဲ့ဖြတ်ချလိုက်တာပါ။ဆိုလိုတာကခင်ဗျားတို့မှာအသိပညာတွေကြွယ်ဝလာပြီး၊ဒီရောဂါတခုလောက်ကိုမိမိမှာမဖြစ်အောင်ကာကွယ်ထားနိုင်ရင်၊ဒါမှမဟုတ်မိမိမှာဖြစ်နေတာကိုပျောက်အောင်ကုသလိုက်နိုင်ရင်တခြားရောဂါတွေအားလုံးကိုလဲအလိုလိုကာကွယ်ပြီးသားကုပြီးသားဖြစ်သွားမယ်ဆိုတာကိုဆိုလိုချင်တာပါ။ခုတ်တတ်ရင်၊တစ်ချက်ခုတ်လိုက်တာနဲ့ဆယ်ချက်လောက်ပြတ်ပါတယ်။
————
ဒီလောက်ရှည်ရှည်ရေးနေတာစကားရှည်ရှည်ပြောချင်လို့မဟုတ်ပါဘူး။ခင်ဗျားတို့မှာဖြစ်နေတဲ့(သို့) ဖြစ်လာနိုင်တဲ့နာတာရှည်ရောဂါအမျိုးမျိုးကိုဆရာဝန်တွေကုလို့မပျောက်သလိုကျွန်တေ်ာ်လဲကုပေးလို့မရပါဘူး။တကယ်ခင်ဗျားတို့ကိုကုပေးနိုင်တာကခင်ဗျားတို့ကိုယ်တိုင်သာလျှင်ဖြစ်ပြီးတော့ပျောက်မပျောက်ကတော့ခင်ဗျားတို့ရဲ့ကိုယ်ပိုင်အသိပညာ၊အတတ်ပညာနဲ့ကျန်းမာရေးဗဟုသုတတွေအပေါ်မှာပဲမူတည်နေပါတယ်။ကျွန်တော်ကဒါတွေတော့မစားကြပါနဲ့။ဒါတွေတော့ရှောင်ကြပါ။ဟိုဟာတွေကိုတော့စားကြပါ၊ဟိုဆေးတွေတော့သောက်ပါ၊ဒီဆေးတွေတော့မသောက်ပါနဲ့လို့လိုက်ပြောနေရင်ဘာနဲ့တူမလဲဆိုတော့နွားကိုပလာတာကျွေးတာနဲ့သွားတူနေပါလိမ့်မယ်၊လာကျွေးလို့တာဝါးစားနေရတာပါပျော့စိစိနဲ့ဘာစားလို့စားနေရမှန်းလဲမသိဘူးကောက်ရိုးမဟုတ်တာတော့သေချာတယ်ဆိုပြီးတော့ထိုင်ဝါးနေလို့ကတော့ဘာမှဖြစ်လာမှာမဟုတ်ပါဘူး။
———–
လောကမှာလူမိုက်တစ်မျိုးနဲ့ပညာရှိသုံးမျိုးရှိပါတယ်။ဘာကွာလဲဆိုတော့လူမိုက်ကသူများပါးစပ်ဖျားလမ်းဆုံးပြီးသူများပြောတဲ့အတိုင်းမဆင်မချင်လိုက်လုပ်တယ်။စာလဲမဖတ်ဘူး၊ဗဟုသုတလဲမရှာဘူး။အကျိုးအကြောင်းဘာမှလဲမသိဘူး။အကျိုးအကြောင်းရှာဖို့လဲစိတ်မဝင်စားဘူး။ကျန်းမာရေးဗဟုသုတမရှာဘူး။မိမိရဲ့အသက်ကိုဆရာဝန်တွေဆေးရံကြီးုတွေအရင်းရှင်ဆေးကုမ္မဏီကြီးတွေရဲ့လက်ထဲကိုပုံအပ်ပေးထားလိုက်တယ်။ပညာနဲနဲရှိတဲ့လူကြတော့နဲနဲပါးပါးစာဖတ်တယ်။ကိုယ်တိုင်ကျန်းမာရေးဗဟုသုတရှာဖွေတယ်။ဗဟုသုတတွေကိုအခြေခံပြီးတော့လုပ်တယ်။ဒီထက်ပိုပြီးပညာရှိလာတဲ့လူကြတော့စာဖတ်တယ်၊ဗဟုသုတရှာဖွေတယ်။ရလာတဲ့ဗဟုသုတကိုဟုတ်မဟုတ်ကိုယ်တိုင်သုသေသနတွေလက်တွေ့စမ်းသပ်လုပ်ကြည့်တယ်။လုပ်ကြည့်တော့လုပ်တဲ့အတိုင်းဖြစ်လာတယ်။ဒါပေမဲ့ဘာဖြစ်လို့ဒီလိုဖြစ်လာရတယ်ဆိုတာကိုတော့အကျိုးအကြောင်းဆက်စပ်ပြီးရှင်းမပြနိင်ဘူး။သေချာလဲမသိဘူး။ပညာအရှိဆုံးလူကတော့ဖြစ်စဉ်တစ်ခုကိုအကျိုးနဲ့အကြောင်းနဲ့ဆက်စပ်ပြီးသေချာသိတယ်၊ဘာအကြောင်းကြောင့်ဘာအကျိုးဖြစ်ရတယ်။ဘာအကြောင်းကိုပါယ်လိုက်ရင်ဘာအကျိုးပျက်စီးသွားမယ်ဆိုတာကောင်းကောင်းသိသလိုသူများကိုလဲနားလည်အောင်ပြန်လည်ရှင်းပြနိုင်တယ်၊ပြန်လဲသင်ကြားပေးနိုင်တယ်။ဒီလေးယောက်မှာခင်ဗျားတို့တွေကိုနောက်ဆုံးအမျိုးအစားပညာအရှိဆုံးလူမျိုးတွေအဖြစ်ပဲဖြစ်စေချင်လို့တမင်အချိန်ကုန်ခံပြီးသဘောတရားအသေးစိတ်တွေကိုရေးပေးနေတာ။ဒီရောဂါမဖြစ်အောင်ဒါတွေရှောင်ကွာ၊ဒါတွေမစားနဲ့ကွာဘာဖြစ်လို့လဲဆိုတာလာမမေးနဲ့ပြောတဲ့အတိုင်းသာလုပ်ပါလို့ကျွန်တော်မပြောလိုဘူး။ဘာကြောင့်လဲဆိုတော့ကျွန်တော့်စာဖတ်မယ့်လူမျိုးတွေကငပိန်းတွေ၊ငတုံးတွေမှမဟုတ်တာ။ငပိန်းတွေငတုံးတွေကလဲဒီလိုစာမျိုးကိုဘယ်တော့မှအချိန်ကုန်ခံပြီးမဖတ်ဘူးဆိုတာသေချာပါတယ်။
———-
ဆိုလိုတာကကျွန်တော်ကခင်ဗျားတို့ကိုရောဂါပျောက်အောင်ကုပေးမှာမဟုတ်ပါဘူး။ခင်ဗျားတို့ကိုယ့်ကိုယ်ကိုပျောက်အောင်ကုနိုင်ဖို့အကျိုးအကြောင်းသဘောတရားတွေကိုသိအောင်သင်ပေးနေရတာဖြစ်လို့ကျွန်တော်ရေးတဲ့စာတွေကရှည်တော့ရှည်ပါတယ်။ကျန်းမာရေးပညာဆိုတာသက်စောင့်ပညာဖြစ်နေလို့ရှည်သလောက်လဲဘဝအတွက်အလွန်အသုံးဝင်ပြီ်းအကျိုးရှိနိုင်ပါတယ်။ရေးရတာရှည်လဲရှည်အပိုင်းဆက်တွေလဲများလို့တချို့ကကုလားကားရိုက်နေတာလားလို့ထင်ချင်ထင်မယ်။ကျွန်တော်ကုလားကားရိုက်နေတာမဟုတ်ပါဘူး။ကျန်းမာရေးပညာဟာအလွန်နုးညံ့သိမ်မွေ့လွန်းလို့အခြေခံသဘောတရားကအစသေချာတဖက်ကမ်းခတ်သိရှိနားလည်စေဖို့စေတနာထားအချိန်ကုန်ခံပြီးတင်ပေးနေတာပါ။ကျွန်တော့်စာဖတ်တဲ့လူတွေအကုန်လုံးသဘောတရားကိုကျမ်းလျောက်နေတာမဟုတ်ပဲကျမ်းပေါက်အောင်သေချာနားလည်တော့မှကိုယ်သိတဲ့အသိပညာအတတ်ပညာနဲ့ကိုယ်တယောက်ထဲအတွက်အကျိုးရှိရုံတင်မကပဲ၊ကိုယ့်မိသားစု၊ကိုယ့်ပါတ်ဝန်းကျင်၊ကိုယ့်အသိုင်းအဝိုင်း၊ကိုယ့်နိုင်ငံ၊ကိုယ့်လူမျိုးအတွက်လဲအကျိုးရှိဖို့လိုအပ်ပါသေးတယ်။အဲဒီလိုအများအကျိုးအတွက်ခင်ဗျားတို့ဆီကနေတဆင့်ပြန့်ပွားစေချင်တဲ့ရည်ရွယ်ချက်ရှိလို့ကိုသေချာအသေးစိတ်စေတနာထားပြီးရေးပေးနေရတာပါ။
—————
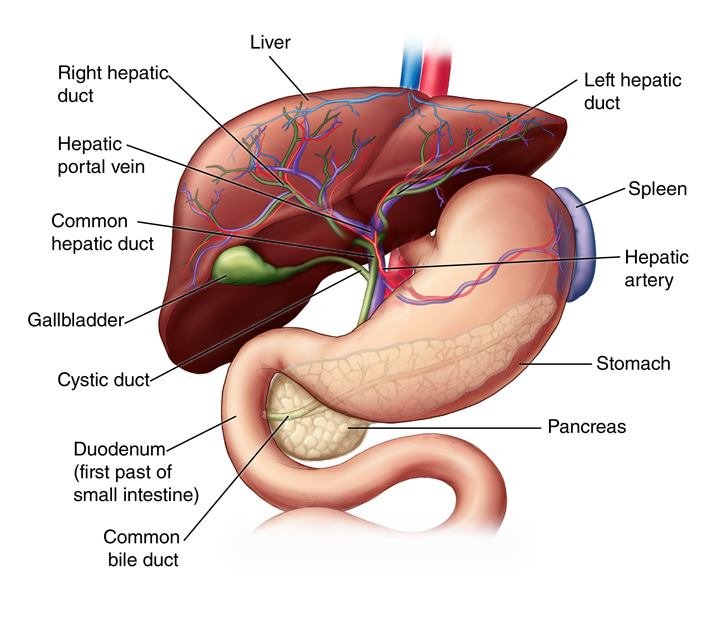
ဆီးချိုအမျိုးအစား(၂)၊(Type-2 Diabetes)အကြောင်းပြန်ဆက်ကြရအောင်၊အပိုင်း(၂)မှာတုံးကဒီရောဂါဟာအသဲကြောင့်ဖြစ်တာပါ၊အသဲရောဂါလို့ကျွန်တော်သေသေချာချာရှင်းပြထားပြီးပါပြီ။မသိသေးတဲ့လူတွေရှိရင်အပိုင်း(၁)နဲ့အပိုင်း(၂)ကိုအရှင်ရှာပြီးဖတ်ကြပါ။ဒါကအပိုင်း(၃)ပါ။ဒီရောဂါဟာအသဲကြောင့်ဖြစ်တယ်ဆိုတော့အသဲကဘာတွေချွတ်ယွင်းပျက်စီးသွားလို့လဲဆိုတာကိုသေချာသဘောပေါက်အောင်အသေးစိတ်ရှင်းပြပါမယ်။အသဲဆိုတာလူ့ခန္ဓာကိုယ်တခုလုံးမှာအလွန်အဓိကကျပြီးအလုပ်လဲအများဆုံးအင်္ဂါတွေထဲကတစ်ခုဖြစ်ပါတယ်။အသဲမှာလုပ်ငန်းဆောင်တာပေါင်း(၅၀၀)လောက်နေ့စဉ်လုပ်ဆောင်နေရပါတယ်။အဲဒီလုပ်ငန်းတွေထဲကအဓိကကျပြီးဒီရောဂါနဲ့ဆက်စပ်နေတဲ့လုပ်ငန်းလမ်းကြောင်းကြီး(၄)ခုကိုဦးစားပေးပြီးဆွေးနွေးသွားပါမယ်။သေသေချာချာတော့နားလည်အောင်ဖတ်ပါ။နားမလည်ရင်လဲနှစ်ခေါက်သုံးခေါက်ပြန်ဖတ်ပေးပါ။ခင်ဗျားတို့သေချာနားလည်တော့မှသူများတွေကိုပြန်ရှင်းပြနိုင်မှာမို့လို့ပါ။
—————-
နံပါတ်(၁)ကတော့(hepatic gluconeogenesis pathways)လို့ခေါ်တဲ့အသဲကနေသကြားဓါတ်ဂလူးကို့စ်(Glucose)ထုတ်ပေးနေတဲ့လမ်းကြောင်းပါ။
——
နံပါတ်(၂)ကတော့ (hepatic de novo lipogenesis pathway)လို့ခေါ်တဲ့အသဲကအဆီမဟုတ်တဲ့ဂလူးကို့စ်တွေကိုအဆီအဖြစ်ပြောင်းလဲပြစ်ကာအသဲကနေသယ်ဆောင်ထုတ်သွားပြီးခန္ဓာကိုယ်အစိတ်အပိုင်းတွေမှာသိမ်းဆည်းတဲ့လမ်းကြောင်းပါ။
————
နံပါတ်(၃)ကတော့(hepatic fatty acid oxidation pathway)စားသုံးလိုက်တဲ့အဆီတွေကိုအသဲကစွမ်းအင်အဖြစ်ပြောင်းလဲပြီးသုံးစွဲပြစ်တဲ့(သို့မဟုတ်)တခြားကိုယ်အင်္ဂါအစိတ်အပိုင်းတွေကအဆီကိုစွမ်းအင်အဖြစ်ကောင်းကောင်းအသုံးပြုလို့ရအောင်ပြင်ဆင်စီမံပေးတဲ့လမ်းကြောင်းပါ။
————
နံပါတ်(၄)ကတော့(hepatic detoxification pathway)လို့ခေါ်တဲ့အသဲကခန္ဓာကိုယ်အတွက်အန္တရာယ်ဖြစ်စေမယ့်အဆိပ်အတောက်တွေကိုစစ်ထုတ်ရှင်းလင်းဖယ်ရှားပြစ်တဲ့လမ်းကြောင်းပါ။
စာဖတ်သူခင်ဗျားတို့နဲ့စာရေးသူကျွန်တော်ရဲ့အလုပ်ကတော့ဒီလမ်းကြောင်းကြီးလေးခုမှာ၊ဘယ်လမ်းကြောင်းတွေမှာထိခိုက်ပျက်စီးနေတာလဲဆိုတာကိုအတူတူအဖြေရှာကြဖို့ပါပဲ။ဒီလိုအဖြေရရင်ရောဂါအမျိုးမျိုးဖြစ်နေတဲ့လူတွေကိုလဲမျှဝေပေးပြီးကုသပေးနိုင်မှာ၊အသက်ကယ်တင်နိုင်မှာဖြစ်ပါတယ်။
——–
နံပါတ်(၁)။ကတော့(hepatic gluconeogenesis pathways)လို့ခေါ်တဲ့အသဲကနေသကြားဓါတ်ဂလူးကို့စ်(Glucose)ထုတ်ပေးတဲ့လမ်းကြောင်းကသိပ်အရေးကြီးပါတယ်။ဒီလမ်းကြောင်းကိုကျွန်တော်တို့စပြီးစစ်ဆေးကြည့်ကြရအောင်။တချို့ဆီးချိုအမှတ်(၂)ရောဂါသမားတွေမှာ၊ညတုံးကကာဗိုဟိုက်ဒရိတ်လဲသိပ်မစားထားဘူး။အစာစားထားပြီးတော်တော်လေးကြာတော့မှညအိပ်ခါနီးသွေးဖေါက်တိုင်းကြည့်ရင်လဲညတုံးကသွေးထဲမှာလဲသကြားဓါတ်ကသိပ်အမြင့်ကြီးတက်မနေဘူး။ဒီကြားထဲအိပ်ရာမဝင်ခင်မှာလဲဘာမှမစားပဲနဲ့အိပ်ရာဝင်လိုက်တယ်။နောက်နေ့မနက်အိပ်ရာကနိုးတော့လဲဘာမှမစားခင်(Fasting)အချိန်မှာသွေးဖေါက်ပြီးဂလူးကို့စ်တိုင်းကြည့်တော့နေရင်းထိုင်ရင်းနဲ့(Glucose)ကအရမ်းကိုမြင့်တက်နေတယ်။ဒီလိုဖြစ်လာပြီဆိုရင်သေချာမိမိဉာဏ်ပညာသုံးပြီးစဉ်းစားဖို့လိုတယ်။ညတုံးကအစာစားထားပြီးတော်တော်ကြာကြာတေ့ာမှတိုင်းကြည့်တော့၊အစာထဲကဂလူးကို့စ်ကလဲကုန်နေပြီ။ညအိပ်ရာမဝင်ခင်ကလဲဘာမှထပ်မစားတော့၊ပြင်ပကလဲဂလူးကို့စ်ကထပ်ဝင်လာစရာအကြောင်းမရှိဘူး။တကယ်ဆိုရင်သကြားဓါတ်ကပြင်ပကဝင်မလာရင်မနက်အစာမစားခင်တိုင်းကြည့်တော့ညကထက်ပိုပြီးလျော့နဲနေရမှာ၊ဘာဖြစ်လို့မလျော့ပဲနဲ့တိုးနေရတာလဲ။သေချာစဉ်းစားကြည့်တော့ပြင်ပက(Glucose)ဝင်မလာဘူးဆိုတော့မိမိခန္ဒာကိုယ်ထဲမှာရှိတဲ့အင်္ဂါအစိတ်အပိုင်းတခုကမလိုအပ်ပဲနဲ့(Glucose)တွေထုတ်ပေးနေတာကတော့သေချာနေပါပြီ။ဘယ်အင်္ဂါဖြစ်မလဲဆိုတော့တခြားအင်္ဂါမရှိပါဘူး၊အသဲကလာတာပါပဲ။တကယ်လို့အသဲကခန္ဓာကိုယ်အတွက်အလွန်လိုအပ်နေလို့ိုထုတ်ပေးတယ်ဆိုရင်တောင်အလွန်ဆုံး(110mg/dl)ကနေ(115mg/dl)လောက်အထိပဲတက်ရမယ်။အဲဒီထက်ပိုပြီးတော့တက်လာစရာအကြောင်းမရှိပါဘူး။သာမှန်အားဖြင့်တော့၊(ketogenic)သမား ကလွဲပြီးသာမန်လူတစ်ယောက်ဟာ(110mg/dl)အောက်မှာပဲရှိရမှာပါ။
——-
ဒါပေမဲ့ဒီနေရာမှာအကြီးအကျယ်ချွင်းချက်ရှိနေသေးတယ်။(Low Carb diet)လုပ်နေတဲ့(ketogenic)သမား(Super Human)တွေမှာကြတော့(Fasting Glucose)ဟာ(125mg/dl)ကနေ(130mg/dl)လောက်အထိတောင်တက်နေနိုင်ပြီးသူတို့မှာတော့ဆီးချိုရှိတယ်လို့ပြောလို့မရနိုင်ပါဘူး။သူတို့တွေကတော့သာမန်လူတွေနဲ့မတူပါဘူး။(fat)ကိုအဓိကထားပြီးသုံးစွဲနိုင်တဲ့ခန္ဓာကိုယ်ဖြစ်အောင်တမင်ကျင့်ကြံထားတော့ခန္ဓာကိုယ် က(Glucose)ကိုသွေးနီဥတွေအတွက်မရမှာကြောက်လို့တမင်သိမ်းထား၊ချန်ထား(reserve)လုပ်ထားရတော့(Fasting Insulin)ကသိပ်နည်းနေပါတယ်။
(Fasting Insulin)လျော့နည်းနေတော့(Glucose)ကမြင့်တက်နေတယ်။အဲဒီလိုလူမျိုးတွေကိုဆရာဝန်တွေတွေ့ရင်၊ဒီလိုလူမျိုးတွေရဲ့ထူးခြားဆန်းပြားတဲ့(metabolism)ကိုဆရာဝန်တွေကမသိပဲနဲ့ဆီးချိုရှိပါတယ်လို့ချက်ချင်းစွဲချက်တင်ပြီးကုသဖို့လုပ်တော့တာပါပဲ။(ketogenic)သမားတွေဆိုတာ(Super Human)တွေလို့ခေါ်ပါတယ်။ကမ္ဘာပေါ်မှာအကျန်းမာဆုံးလူတွေပါ။သူတို့ကိုယ်မှာဆီးချိုမပြောနဲ့ကင်ဆာရောဂါတောင်မဖြစ်လာနိုင်ပါဘူး။(ketogenic adaptation)ဖြစ်ဖို့ဆိုတာကလဲမလွယ်ဘူးလေ။တော်တော်ကိုကျိုးစားပြီးလပေါင်းများစွာကျင့်ယူရတာပါ။တကယ်လို့ဖြစ်သွားပြီဆိုရင်တော့ဆီးချိုရောဂါမပြောနဲ့ကင်ဆာရောဂါတောင်ကြက်ပျောက်ငှက်ပျောက်၊ပျောက်သွားတာပါပဲ။ဒါကြောင့်မို့သူတို့ကို(Super Human)လို့ခေါ်ကြတာပေါ့။ဒီနေရာမှာ(ketogenic)ဆိုတာဟာ၊ဆီးချိုသမားတွေအတွက်အလွန်အန္တရာယ်ရှိတဲ့သွေးထဲမှာအက်ဆစ်ဓါတ်များသွားတဲ့(ketoacidosis complication)ဆိုတဲ့သဘောနဲ့လုံးဝမတူပါဘူး။အဲဒါကိုကွဲကွဲပြားပြားနားလည်စေချင်ပါတယ်။(ketogenic diet)ဆိုတာ(Type-2 diabetes)သမားတွေကိုချက်ခြင်းပျောက်ကင်းစေနိုင်တဲ့အကောင်းဆုံးစားသောက်နေထိုင်နည်းတခုပါ။ဒါပေမဲ့စနစ်ကျဖို့တော့လိုပါတယ်။စနစ်မကျရင်အန္တရာယ်ရှိနိုင်ပါတယ်။နောက်မှ(ketogenic diet)အကြောင်းကိုစနစ်တကျသင်ပေးပါမယ်။
———–
ပြန်ဆက်ကြရအောင်၊(super Human)ခေါ်(ketogenic)သမားမဟုတ်ပဲနဲ့သာမန်လူတစ်ယောက်ဟာမနက်မိုးလင်းအစာမစားခင်တိုင်းကြည့်လို့(Glucose)က(110-115)ထက်ကျော်နေပြီဆိုရင်တော့အသဲရဲ့(hepatic gluconeogenesis pathways) လို့ခေါ်တဲ့အသဲကနေသကြားဓါတ်ဂလူးကို့စ်(Glucose)ထုတ်လုပ်ပေးမှုစနစ်ဟာမှားယွင်းနေတာသေချာနေပါပြီ။မှားယွင်းတယ်ဆိုတာကသကြားဓါတ်ဂလူးကို့စ်မထုတ်ပေးနိုင်တာကိုဆိုလိုတာမဟုတ်ပါဘူး။သကြားဓါတ်ဂလူးကို့စ်ထုတ်လုပ်မူ့ဟာသာမန်ထက်ပိုပြီးများနေတာပါ။ပုံမှန်အားဖြင့်ဒီလိုထုတ်လုပ်မှုဟာသွေးထဲမှာသကြားဓါတ်လျော့နည်းသွားတာနဲ့အလိုလိုဖြစ်ပေါ်လာပြီးသွေးထဲမှာသကြားဓါတ်လုံလောက်များပြားလာတဲ့အခါမှာရပ်ကိုရပ်တန့်သွားရပါမယ်။အသဲကဒီလုပ်ငန်းစဉ်ကိုရပ်သင့်တဲ့အချိန်မှာမရပ်ပဲနဲ့ဆက်ပြီးထုတ်လုပ်နေတယ်ဆိုရင်တော့ပြဿနာရှိနေပါပြီ။အဲဒီလိုရပ်ပြစ်ဖို့တာဝန်ကအင်ဆူလင်ဟော်မုန်းမှာတာဝန်ရှိနေပါတယ်။သူကရပ်ပြစ်ဖို့အသဲကိုစေခိုင်းရမှာပါ။ဒါပေမဲ့တခုသေချာမသိနိုင်တာက၊သွေးထဲမှာအင်ဆူလင်လုံးဝမရှိလို့ဒီလုပ်ငန်းစဉ်ကိုရပ်တန့်သင့်တဲ့အချိန်အခါမှာမရပ်တန့်နိုင်တာများလား။ဆိုလိုတာကအင်ဆူလင်ဟော်မုန်းထုတ်ပေးရတဲ့ပန်ကရိယကတခုခုချွတ်ယွင်းပျက်စီးနေပြီးသကြားဓါတ်ကိုသွေးထဲမှာတွေ့တာနဲ့အင်ဆူလင်အလုံအလောက်ထုတ်မပေးနိုင်တာများလား၊ဒါမှမဟုတ်သွေးထဲမှာအင်ဆူလင်တွေရှိရဲ့သားနဲ့အသဲကအင်ဆူလင်ခိုင်းတာကိုဂရုမစိုက်ပဲနဲ့၊မလိုက်နာတော့ပဲနဲ့သကြားထုတ်တဲ့လုပ်ငန်းကိုမရပ့်တန့်ပဲနဲ့ပေပြီးတော့ဆက်လက်လုပ်နေတာများလားအတိအကျသိမှကိုရပါတော့မယ်။အသဲကအင်ဆူလင်ခိုင်းတာကိုဂရုမစိုက်ဘူး၊မလိုက်နာဘူးဆိုရင်တော့အသဲမှာ(hepatic insulin resistance)လို့ခေါ်တဲ့အင်ဆူလင်ကိုခုခံတဲ့ရောဂါဖြစ်နေပါပြီ။
———
ဒါတွေကိုတိတိကျကျသိမှသာရောဂါရဲ့အကြောင်းအရင်းကိုပြောနိုင်မှာဖြစ်ပါတယ်။ကိုယ့်ရောဂါဟာလဲမိမိရဲ့ခုခံမှုစနစ်ကမိမိပန်ခရိယကိုပြန်ပြီးတိုက်ခိုက်ဖျက်ဆီးခံရတဲ့(Auto immune) ဖြစ်နေတဲ့(type-1 Diabetes)များလား။ဒါမှမဟုတ်အသဲကအင်ဆူလင်ခိုင်းတာကိုဂရုမစိုက်တဲ့အင်ဆူလင်ခုခံမှုရောဂါ(type-2 Diabetes)များလားဆိုတာသေသေချာချာကွဲကွဲပြားပြားသိကိုသိရပါတော့မယ်။ဒီနေရာမှာ(type-1)လား(type-2)လားဆိုတာဆရာဝန်ပြောတာကိုထိုင်ယုံနေလို့တော့မရပါဘူးကိုယ်တိုင်တိတိကျကျသိကိုသိရပါတော့မယ်။(Type-1 Diabetes) ဆိုတာက(Autoimmune Disease)သက်သက်သာဖြစ်ပြီး(Type-2 Diabetes)ဆိုတာကတော့ (Metabolic Disease)ဖြစ်နေလို့၊(type-1)နဲ့(type-2)ဟာလုံးဝမတူပဲရာနုန်းပြည့်ကွဲပြားနေပါတယ်။အဲဒါကိုသေချာမသိရင်ရှေ့ဆက်သွားလို့ကိုမရပါဘူး။ဒီအချိန်ဒီပြဿတာကိုဃဂ၊ဏနသေချာသိနိုင်ဖို့အလွန်အရေးကြီးတဲ့သွေးစစ်ဆေးမှုတခုပြုလုပ်ရပါမယ်။အဲဒီစစ်ဆေးမှုကတော့(fasting Insulin test) လို့ခေါ်ပါတယ်။(Insulin)အသုံးပြုနေတဲ့ဆီးချိုသမားတွေအင်ဆူလင်ထိုးထားရင်(fasting Insulin test) တိုင်းလို့မရပါဘူး။အင်ဆူလင်မထိုးထားသူတွေသာမနက်အစာမစားခင်(Glucose)တိုင်းရုံတင်မကဘူး၊(fasting Insulin)ကိုပါဓါတ်ခွဲခန်းမှာသွားပြီးတိုင်းကြည့်လိုက်လို့(Fasting Insulin)ဟာပုံမှန်ထက်အရမ်းကိုနည်းနေပြီး(Zero)နားကပ်နေရင်တော့အဖြေကအသဲကောင်းနေပြီး၊ပန်ခရိယပျက်စီးနေတာဖြစ်လို့(Type-1 Diabetes)သို့မဟုတ်(Autoimmune Disease)သက်သက်ဖြစ်လိုဒီပို့စ်မှာပြောမယ့်နည်းလမ်းတွေနဲ့ကုသလို့မရတော့ပါဘူး၊လမ်းကြောင်းတခုခွဲထွက်သွားပါပြီ။တကယ်လို့(fasting Insulin)ဟာပုံမှန်ထက်များနေရင်တော့(Type-2 Diabetes)ဆိုတာသေချာနေတော့အသဲကြောင့်ဖြစ်တာ၊အသဲကအင်ဆူလင်စကားနားမထောင်ပဲခုခံဆန့်ကျင်နေတာဖြစ်လို့ဒီပို့စ်မှာဆက်ရေးပေးမယ့်အတိုင်းအသဲကိုဦးစားပေးကုသရမှာဖြစ်ပါတယ်။တကယ်လို့(fasting Insulin)ဟာပုံမှန်ရှိနေတယ်ဆိုရင်တော့(Fasting Glucose)တက်နေတာကိုသိပ်အလေးထားဂရုစိုက်နေစရာမလိုတော့ပါဘူး။ကိုယ့်ခန္ဓာကိုယ်က(ketogenic effect)ဖြစ်နေတာပါ။(ketogenic effect)ဆိုတာအလွန်ကျန်းမာပြီးကင်ဆာရောဂါကိုပါကာကွယ်ပေးနိုင်တဲ့အလွန်ထူးခြားတဲ့သဘောတရားတစ်ခုပါ။(Ketogenic effect)တခါတလေဖြစ်တယ်ဆိုတာကလဲနည်းတဲ့အကျိုးကျေးဇူးမဟုတ်ပါဘူး။လူတိုင်းမှာ(၉၀%)လောက်ကမလုပ်ယူပဲနဲ့မဖြစ်ပါဘူး။သို့သော်ဥပုသ်သီလကိုကောင်းမွန်စွာမကျိုးမပေါက်စောင့်ထိန်းတတ်ပြီးညနေပိုင်းမှာဘာအစာမှလဲမစားအချိုရေလဲမသောက်၊ရေနဲ့ရေနွေးကြမ်းကိုပဲသောက်တတ်တဲ့လူတွေ။သီလစင်ကြယ်တဲ့သံဃာတော်တွေမှာတော့အမြဲလိုလိုဖြစ်နေတတ်ပါတယ်။မြတ်စွာဘုရားစကားအတိုင်းညစာမစားပဲ၊အချိုရေတွေလဲမသောက်ပဲ၊ဥပုသ်စောင့်ခြင်းဟာအလွန်အကျိုးများတဲ့အပြင်ကင်ဆာကအစပြုလို့ဘာရောဂါဆိုးမှလဲမိမိခန္ဒာကိုယ်ကိုမဝင်ရောက်နိုင်လို့အရမ်းကိုအကျိုးကျေးဇူးကြီးမားပါတယ်ဆိုတဲ့အကြောင်းကိုနောက်အချိန်ရရင်သီးသန့်သုသေသနအထောက်အထားတွေနဲ့သေချာရေးပေးပါမယ်။အခုတော့လိုရင်းကိုဆက်ပါဦးမယ်။
—————————-
တိုတိုပြောရရင်အခုခေတ်ဆေးပညာမှာအဓိကထားတိုင်းတာနေတဲ့(Fasting Glucose Test)တွေဟာဆီးချိုရောဂါရဲ့အခြေအနေကိုသိဖို့သိပ်ပြီးအသုံးမဝင်တော့ပါဘူး။တော်တော်လေးကိုခေတ်နောက်ကျသွားပါပြီ။(Hba1c)တိုင်းတာမှု့တောင်မှသိပ်မသေချာတေ့ာပါဘူး။ဆိုလိုတာက(Hba1c)ဆိုတာကလွန်ခဲ့တဲ့သုံးလအတွင်းကသွေးထဲမှာ(Glycated)ဖြစ်ပြီးရှိနေတဲ့(glucose)ရဲ့မမာဏကိုတိုင်းတာတာဖြစ်လို့၊ဆီးချိုသမားတွေမှာ(Hba1c)ပုံမှန်ဖြစ်နေရုံနဲ့တော့အဆင်ပြေတယ်(OK)တယ်လို့တော့ပြောလို့မရပါဘူး။ဆီးချိုစဖြစ်တဲ့လူတွေမှာ၊ဒါမှမဟုတ်ကာကွယ်ထားချင်တဲ့လူတွေမှာတော့(Hba1c)တိုင်းတာမှုဟာအလွန်အသုံးဝင်ပေမဲ့၊ဆီးချိုသမားတွေဆီမှာတော့ဒီတိုင်းတာမှုဟာလွဲချင်လွဲနေနိုင်ပါတယ်။ဘာကြောင့်လဲဆိုတော့ဆီးချိုရောဂါသည်ဆိုတာကသွေးထဲမှာဂလူးကို့စ်အရမ်းတက်နေတဲ့အချိန်တွေရှိသလို၊အရမ်းကျနေတဲ့အချိန်တွေလဲမကြာမကြာဖြစ်တတ်ပါသေးတယ်။တကယ်တော့်ကျတာလဲမကောင်းသလိုတက်တာလဲမကောင်းပါဘူး။ပုံမှန်ကတော့အကောင်းဆုံးပါ။ဆိုလိုတာကတခါတလေ(150mg/dl)ထိတက်မယ်။တခါတလေ(50mg/dl)အထိထိုးကျမယ်ဆိုရင်၊(150)နဲ့(50)ကိုပျှမ်းမျှယူလိုက်ရင်(100)ဖြစ်နေပါလေရော။အဲဒီလိုအတက်အကျများလို့ပျမ်းမျှယူလိုက်လို့(100)ရှိနေတဲ့ရောဂါသည်ဟာ၊အတက်အကျသိပ်မရှိပဲအမြဲတန်းလိုလိုပျမ်းမျှ(100)ရှိနေတဲ့လူနဲ့တော့မတူနိုင်ပါဘူး။သို့သော်(Hba1c)ဟာပျှမ်းမျှတန်ဖိုးဖြစ်လို့အတက်အကျများနေတဲ့လူနာတွေမှာလူကောင်းတစ်ယောက်လိုပုံမှန်ပြနေတတ်ပါတယ်။ဒါကြောင့်သိပ်ပြီးတော့ယုံကြည်စိတ်ချရတဲ့တိုင်းတာမှုမျိုးမဟုတ်ပါဘူးလို့ဆိုချင်တာပါ။ချွင်းချက်ရှိနေတဲ့စံနနု်းစံထားတစ်ခုပါ။
————-
အယုံကြည်အစိတ်ချရဆုံးတိုင်းတာမှုကတော့(Fasting Insulin Test)နဲ့(75 grams glucose tolerance test)ပါပဲ။(glucose tolerance test)ဆိုတာကတော့မနက်မိုးလင်းလင်းချင်းအစာမစားခင်မှာ(Glucose 75grams)ကိုရေဖျော်သောက်လိုက်ပြီးသွေးထဲမှာနာရီဝက်ခြားတခါ(၆)ကြိမ်(၃)နာရီကြာကြာလောက်(Glucose)ဆက်တိုက်တိုင်းပြီး(Graph)ဆွဲကြည့်တာပါ။အဲဒီ(Graph)ကိုကြည့်ပြီး(calculus)သင်္ချာနည်းနဲ့အင်ဆူလင်ဟော်မုန်းရဲ့တုန့်ပြန်မှုကိုပြန်ပြီးတွက်ယူတာပါ။အသဲရဲ့ပထမလမ်းကြောင်းကြီးဖြစ်တဲ့(hepatic gluconeogenesis pathways)အလုပ်မလုပ်ပဲ(insulin)ခုခံမှုဖြစ်နေတာလား။ဒါမှမဟုတ်အင်ဆူလင်ထုတ်ပေးတဲ့ပန်ခရိယမကောင်းတာလား။(Type-2 Diabetes)လား(Type-1 Diabetes)လားဆိုတာဟာ(Fasting Insulin Test)နဲ့သာလျှင်ဆုံးဖြတ်နိုင်ပါလိမ့်မယ်။ဒါကြောင့်မိုလို့ဆီးချိုရောဂါရှိသည်ဖြစ်စေမရှိသည်ဖြစ်စေ၊အသက်ရှည်ကျန်းမာလိုသူတိုင်း(Fasting Insulin)ကိုတော့တိုင်းတာစစ်ဆေးသင့်ပါတယ်။ပုံမှန်(Fasting insulin reference range)က(3)uIU/mL—-ကနေ—(8)uIU/mL)ပါ။
———-
ဒီနေ့တော့ဒီလောက်ပါပဲ။နောက်တော့မှကျန်နေတဲ့တခြားလမ်းကြောင်းကြီး(၃)ခုအကြောင်းကိုဆက်ဆွေးနွေးပြီးစာဖတ်သူတို့နှင့်အတူအဖြေရှာကြပါမည်။ဘယ်လမ်းကြောင်းပျက်စီးနေရင်ဘာကြောင့်ဆိုတာခင်ဗျားတို့ကိုယ်တိုင်အကြောင်းနဲ့အကျိုးဆက်စပ်ပြီးတိတိကျကျသေချာနားလည်သဘောပေါက်လာမှာပါ။အဲဒီလိုသဘောပေါက်လာရင်၊ဘယ်ကနေဘယ်လိုကာကွယ်ရမယ်ကုသရမည်ဆိုတာတင်မကပါဘူးခင်ဗျားတို့ကိုယ်တိုင်ဆီးချိုရောဂါနဲ့ပါတ်သက်ပြီးကျွမ်းကျင်သူအဆင့်(expert) ဖြစ်သွားလို့သူများတွေကိုလဲကူညီကယ်တင်ကုသပေးနိုင်မှာပါ။ခေတ္တနားပါဦးမည်။မကြာခင်အပိုင်း(၄)ကိုဆက်ရေးပေးပါမည်။
Kelvin Albert Power
—–
အပိုင်း(၁)Links ဒီမှာယူပါ။
https://www.facebook.com/kelvin.power.1675/posts/124887625454320
အပိုင်း(၂)Links ဒီမှာယူပါ။
https://www.facebook.com/kelvin.power.1675/posts/125787785364304
References———————-
1. Ekberg K, et al. Contributions by kidney and liver to glucose production in the postabsorptive state and after 60 h of fasting. Diabetes. 1999;48:292–298. [PubMed] [Google Scholar]
2. Moore MC, Coate KC, Winnick JJ, An Z, Cherrington AD. Regulation of hepatic glucose uptake and storage in vivo. Adv Nutr. 2012;3:286–294. [PMC free article] [PubMed] [Google Scholar]
3. Rizza RA. Pathogenesis of fasting and postprandial hyperglycemia in type 2 diabetes: implications for therapy. Diabetes. 2010;59:2697–2707. [PMC free article] [PubMed] [Google Scholar]
4. Moore MC, et al. Sources of carbon for hepatic glycogen synthesis in the conscious dog. J Clin Invest. 1991;88:578–587. [PMC free article] [PubMed] [Google Scholar]
5. Rothman DL, Magnusson I, Katz LD, Shulman RG, Shulman GI. Quantitation of hepatic glycogenolysis and gluconeogenesis in fasting humans with 13C NMR. Science. 1991;254:573–576. [PubMed] [Google Scholar]
6. Mari A, Wahren J, DeFronzo RA, Ferrannini E. Glucose absorption and production following oral glucose: comparison of compartmental and arteriovenous-difference methods. Metabolism. 1994;43:1419–1425. [PubMed] [Google Scholar]
7. Ishida T, et al. Differential effects of oral, peripheral intravenous, and intraportal glucose on hepatic glucose uptake and insulin and glucagon extraction in conscious dogs. J Clin Invest. 1983;72:590–601. [PMC free article] [PubMed] [Google Scholar]
8. Pagliassotti MJ, Cherrington AD. Regulation of net hepatic glucose uptake in vivo. Annu Rev Physiol. 1992;54:847–860. [PubMed] [Google Scholar]
9. Ferrannini E, et al. The disposal of an oral glucose load in healthy subjects A quantitative study. Diabetes. 1985;34:580–588. [PubMed] [Google Scholar]
10. Petersen KF, Laurent D, Rothman DL, Cline GW, Shulman GI. Mechanism by which glucose and insulin inhibit net hepatic glycogenolysis in humans. J Clin Invest. 1998;101:1203–1209. [PMC free article] [PubMed] [Google Scholar]
11. Lin HV, Accili D. Hormonal regulation of hepatic glucose production in health and disease. Cell Metab. 2011;14:9–19. [PMC free article] [PubMed] [Google Scholar]
12. Cherrington AD, Edgerton D, Sindelar DK. The direct and indirect effects of insulin on hepatic glucose production in vivo. Diabetologia. 1998;41:987–996. [PubMed] [Google Scholar]
13. Pagliassotti MJ, Moore MC, Neal DW, Cherrington AD. Insulin is required for the liver to respond to intraportal glucose delivery in the conscious dog. Diabetes. 1992;41:1247–1256. [PubMed] [Google Scholar]
14. McGuinness OP, Ayala JE, Laughlin MR, Wasserman DH. NIH experiment in centralized mouse phenotyping: the Vanderbilt experience and recommendations for evaluating glucose homeostasis in the mouse. Am J Physiol Endocrinol Metab. 2009;297:E849–E855. [PMC free article] [PubMed] [Google Scholar]
15. Kowalski GM, Bruce CR. The regulation of glucose metabolism: implications and considerations for the assessment of glucose homeostasis in rodents. Am J Physiol Endocrinol Metab. 2014;307:E859–E871. [PubMed] [Google Scholar]
16. Steele R, et al. Inhibition by insulin of hepatic glucose production in the normal dog. Am J Physiol. 1965;208:301–306. [PubMed] [Google Scholar]
17. Rizza RA, Mandarino LJ, Gerich JE. Dose–response characteristics for effects of insulin on production and utilization of glucose in man. Am J Physiol. 1981;240:E630–E639. [PubMed] [Google Scholar]
18. Basu A, Shah P, Nielsen M, Basu R, Rizza RA. Effects of type 2 diabetes on the regulation of hepatic glucose metabolism. J Investig Med. 2004;52:366–374. [PubMed] [Google Scholar]
19. Magnusson I, Rothman DL, Katz LD, Shulman RG, Shulman GI. Increased rate of gluconeogenesis in type II diabetes mellitus. A 13C nuclear magnetic resonance study. J Clin Invest. 1992;90:1323–1327. [PMC free article] [PubMed] [Google Scholar]
20. Perry RJ, Samuel VT, Petersen KF, Shulman GI. The role of hepatic lipids in hepatic insulin resistance and type 2 diabetes. Nature. 2014;510:84–91. [PMC free article] [PubMed] [Google Scholar]
21. Kumashiro N, et al. Cellular mechanism of insulin resistance in nonalcoholic fatty liver disease. Proc Natl Acad Sci USA. 2011;108:16381–16385. [PMC free article] [PubMed] [Google Scholar]
22. Petersen KF, et al. Reversal of nonalcoholic hepatic steatosis, hepatic insulin resistance, and hyperglycemia by moderate weight reduction in patients with type 2 diabetes. Diabetes. 2005;54:603–608. [PMC free article] [PubMed] [Google Scholar]
23. Petersen KF, et al. Leptin reverses insulin resistance and hepatic steatosis in patients with severe lipodystrophy. J Clin Invest. 2002;109:1345–1350. [PMC free article] [PubMed] [Google Scholar]
24. Perry RJ, Zhang D, Zhang X-M, Boyer JL, Shulman GI. Controlled-release mitochondrial protonophore reverses diabetes and steatohepatitis in rats. Science. 2015;347:1253–1256. [PMC free article] [PubMed] [Google Scholar]
25. Perry RJ, et al. Reversal of hypertriglyceridemia, fatty liver disease, and insulin resistance by a liver-targeted mitochondrial uncoupler. Cell Metab. 2013;18:740–748. [PMC free article] [PubMed] [Google Scholar]
26. Kim JK, Gavrilova O, Chen Y, Reitman ML, Shulman GI. Mechanism of insulin resistance in A-ZIP/F-1 fatless mice. J Biol Chem. 2000;275:8456–8460. [PubMed] [Google Scholar]
27. Samuel VT, Shulman GI. Mechanisms for insulin resistance: common threads and missing links. Cell. 2012;148:852–871. [PMC free article] [PubMed] [Google Scholar]
28. Magkos F, et al. Intrahepatic diacylglycerol content is associated with hepatic insulin resistance in obese subjects. Gastroenterology. 2012;142:1444–1446 e2. [PMC free article] [PubMed] [Google Scholar]
29. Luukkonen PK, et al. Hepatic ceramides dissociate steatosis and insulin resistance in patients with nonalcoholic fatty liver disease. J Hepatol. 2016;64:1167–1175. [PubMed] [Google Scholar]
30. ter Horst KW, et al. Hepatic diacylglycerol-associated protein kinase Cε translocation links hepatic steatosis to hepatic insulin resistance in humans. Cell Rep. 2017;19:1997–2004. [PMC free article] [PubMed] [Google Scholar]
31. Samuel VT, et al. Inhibition of protein kinase Cε prevents hepatic insulin resistance in nonalcoholic fatty liver disease. J Clin Invest. 2007;117:739–745. [PMC free article] [PubMed] [Google Scholar]
32. Samuel VT, et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004;279:32345–32353. [PubMed] [Google Scholar]
33. Petersen MC, et al. Insulin receptor Thr1160 phosphorylation mediates lipid-induced hepatic insulin resistance. J Clin Invest. 2016;126:4361–4371. [PMC free article] [PubMed] [Google Scholar]
34. Michelotti GA, Machado MV, Diehl AM. NAFLD, NASH and liver cancer. Nat Rev Gastroenterol Hepatol. 2013;10:656–665. [PubMed] [Google Scholar]
35. Williams AS, et al. Integrin-linked kinase is necessary for the development of diet-induced hepatic insulin resistance. Diabetes. 2017;66:325–334. [PMC free article] [PubMed] [Google Scholar]
36. Boden G. Gluconeogenesis and glycogenolysis in health and diabetes. J Investig Med. 2004;52:375–378. [PubMed] [Google Scholar]
37. Chen X, Iqbal N, Boden G. The effects of free fatty acids on gluconeogenesis and glycogenolysis in normal subjects. J Clin Invest. 1999;103:365–372. [PMC free article] [PubMed] [Google Scholar]
38. Katz J, Tayek JA. Gluconeogenesis and the Cori cycle in 12-, 20-, and 40-h-fasted humans. Am J Physiol. 1998;275:E537–E542. [PubMed] [Google Scholar]
39. Landau BR, et al. Contributions of gluconeogenesis to glucose production in the fasted state. J Clin Invest. 1996;98:378–385. [PMC free article] [PubMed] [Google Scholar]
40. Levine R, Fritz IB. The relation of insulin to liver metabolism. Diabetes. 1956;5:209–219. [PubMed] [Google Scholar]
41. Gaisano H, MacDonald PE, Vranic M. Glucagon secretion and signaling in the development of diabetes. Front Physiol. 2012;3:349. [PMC free article] [PubMed] [Google Scholar]
42. Pearson MJ, Unger RH, Holland WL. Clinical trials, triumphs, and tribulations of glucagon receptor antagonists. Diabetes Care. 2016;39:1075–1077. [PMC free article] [PubMed] [Google Scholar]
43. Ader M, Bergman RN. Peripheral effects of insulin dominate suppression of fasting hepatic glucose production. Am J Physiol. 1990;258:E1020–E1032. [PubMed] [Google Scholar]
44. Lewis GF, Zinman B, Groenewoud Y, Vranic M, Giacca A. Hepatic glucose production is regulated both by direct hepatic and extrahepatic effects of insulin in humans. Diabetes. 1996;45:454–462. [PubMed] [Google Scholar]
45. Sindelar DK, Balcom JH, Chu CA, Neal DW, Cherrington AD. A comparison of the effects of selective increases in peripheral or portal insulin on hepatic glucose production in the conscious dog. Diabetes. 1996;45:1594–1604. [PubMed] [Google Scholar]
46. Prager R, Wallace P, Olefsky JM. Direct and indirect effects of insulin to inhibit hepatic glucose output in obese subjects. Diabetes. 1987;36:607–611. [PubMed] [Google Scholar]
47. Staehr P, et al. Effects of free fatty acids per se on glucose production, gluconeogenesis, and glycogenolysis. Diabetes. 2003;52:260–267. [PubMed] [Google Scholar]
48. Lewis GF, Vranic M, Harley P, Giacca A. Fatty acids mediate the acute extrahepatic effects of insulin on hepatic glucose production in humans. Diabetes. 1997;46:1111–1119. [PubMed] [Google Scholar]
49. Sindelar DK, et al. The role of fatty acids in mediating the effects of peripheral insulin on hepatic glucose production in the conscious dog. Diabetes. 1997;46:187–196. [PubMed] [Google Scholar]
50. Rebrin K, Steil GM, Mittelman SD, Bergman RN. Causal linkage between insulin suppression of lipolysis and suppression of liver glucose output in dogs. J Clin Invest. 1996;98:741–749. [PMC free article] [PubMed] [Google Scholar]
51. Perry RJ, et al. Hepatic acetyl coa links adipose tissue inflammation to hepatic insulin resistance and type 2 diabetes. Cell. 2015;160:745–758. [PMC free article] [PubMed] [Google Scholar]
52. Perry RJ, et al. Leptin reverses diabetes by suppression of the hypothalamic–pituitary–adrenal axis. Nat Med. 2014;20:759–763. [PMC free article] [PubMed] [Google Scholar]
53. Perry RJ, Peng L, Shulman GI. Mechanism for leptin’s acute insulin-independent effect to reverse diabetic ketoacidosis. J Clin Invest. 2017;127:657–669. [PMC free article] [PubMed] [Google Scholar]
54. Previs SF, Cline GW, Shulman GI. A critical evaluation of mass isotopomer distribution analysis of gluconeogenesis in vivo. Am J Physiol. 1999;277:E154–E160. [PubMed] [Google Scholar]
55. Krebs HA, Speake RN, Hems R. Acceleration of renal gluconeogenesis by ketone bodies and fatty acids. Biochem J. 1965;94:712–720. [PMC free article] [PubMed] [Google Scholar]
56. Keech DB, Utter MF. Pyruvate carboxylase. II Properties. J Biol Chem. 1963;238:2609–2614. [PubMed] [Google Scholar]
57. Williamson JR, Kreisberg RA, Felts PW. Mechanism for the stimulation of gluconeogenesis by fatty acids in perfused rat liver. Proc Natl Acad Sci USA. 1966;56:247–254. [PMC free article] [PubMed] [Google Scholar]
58. Lu M, et al. Insulin regulates liver metabolism in vivo in the absence of hepatic Akt and Foxo1. Nat Med. 2012;18:388–395. [PMC free article] [PubMed] [Google Scholar]
59. Buettner C, et al. Severe impairment in liver insulin signaling fails to alter hepatic insulin action in conscious mice. J Clin Invest. 2005;115:1306–1313. [PMC free article] [PubMed] [Google Scholar]
60. Okamoto H, Obici S, Accili D, Rossetti L. Restoration of liver insulin signaling in Insr knockout mice fails to normalize hepatic insulin action. J Clin Invest. 2005;115:1314–1322. [PMC free article] [PubMed] [Google Scholar]
61. Chen YD, Golay A, Swislocki AL, Reaven GM. Resistance to insulin suppression of plasma free fatty acid concentrations and insulin stimulation of glucose uptake in noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab. 1987;64:17–21. [PubMed] [Google Scholar]
62. Fraze E, et al. Ambient plasma free fatty acid concentrations in noninsulin-dependent diabetes mellitus: evidence for insulin resistance. J Clin Endocrinol Metab. 1985;61:807–811. [PubMed] [Google Scholar]
63. Reaven GM, Hollenbeck C, Jeng CY, Wu MS, Chen YD. Measurement of plasma glucose, free fatty acid, lactate, and insulin for 24 h in patients with NIDDM. Diabetes. 1988;37:1020–1024. [PubMed] [Google Scholar]
64. Golay A, Swislocki AL, Chen YD, Reaven GM. Relationships between plasma-free fatty acid concentration, endogenous glucose production, and fasting hyperglycemia in normal and non-insulin-dependent diabetic individuals. Metabolism. 1987;36:692–696. [PubMed] [Google Scholar]
65. Swislocki AL, Chen YD, Golay A, Chang MO, Reaven GM. Insulin suppression of plasma-free fatty acid concentration in normal individuals and patients with type 2 (non-insulin-dependent) diabetes. Diabetologia. 1987;30:622–626. [PubMed] [Google Scholar]
66. Charles MA, et al. The role of non-esterified fatty acids in the deterioration of glucose tolerance in Caucasian subjects: results of the Paris Prospective Study. Diabetologia. 1997;40:1101–1106. [PubMed] [Google Scholar]
67. Paolisso G, et al. A high concentration of fasting plasma non-esterified fatty acids is a risk factor for the development of NIDDM. Diabetologia. 1995;38:1213–1217. [PubMed] [Google Scholar]
68. Jocken JWE, et al. Insulin-mediated suppression of lipolysis in adipose tissue and skeletal muscle of obese type 2 diabetic men and men with normal glucose tolerance. Diabetologia. 2013;56:2255–2265. [PMC free article] [PubMed] [Google Scholar]
69. Heptulla RA, et al. In situ evidence that peripheral insulin resistance in adolescents with poorly controlled type 1 diabetes is associated with impaired suppression of lipolysis: a microdialysis study. Pediatr Res. 2003;53:830–835. [PubMed] [Google Scholar]
70. Gelding SV, Coldham N, Niththyananthan R, Anyaoku V, Johnston DG. Insulin resistance with respect to lipolysis in non-diabetic relatives of European patients with type 2 diabetes. Diabet Med. 1995;12:66–73. [PubMed] [Google Scholar]
71. Robinson C, et al. Effect of insulin on glycerol production in obese adolescents. Am J Physiol. 1998;274:E737–E743. [PubMed] [Google Scholar]
72. Puhakainen I, Koivisto VA, Yki-Järvinen H. Lipolysis and gluconeogenesis from glycerol are increased in patients with noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab. 1992;75:789–794. [PubMed] [Google Scholar]
73. Nurjhan N, Consoli A, Gerich J. Increased lipolysis and its consequences on gluconeogenesis in non-insulin-dependent diabetes mellitus. J Clin Invest. 1992;89:169–175. [PMC free article] [PubMed] [Google Scholar]
74. Perry RJ, Peng L, Cline GW, Petersen KF, Shulman GIA. Non-invasive method to assess hepatic acetyl-CoA in vivo. Cell Metab. 2017;25:749–756. [PMC free article] [PubMed] [Google Scholar]
75. American Diabetes Association. 7. Approaches to glycemic treatment. Diabetes Care. 2016;39:S52–S59. [PubMed] [Google Scholar]
76. Hundal RS, et al. Mechanism by which metformin reduces glucose production in type 2 diabetes. Diabetes. 2000;49:2063–2069. [PMC free article] [PubMed] [Google Scholar]
77. Inzucchi SE, et al. Efficacy and metabolic effects of metformin and troglitazone in type II diabetes mellitus. N Engl J Med. 1998;338:867–872. [PubMed] [Google Scholar]
78. Zhou G, et al. Role of AMP-activated protein kinase in mechanism of metformin action. J Clin Invest. 2001;108:1167–1174. [PMC free article] [PubMed] [Google Scholar]
79. Shaw RJ, et al. The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science. 2005;310:1642–1646. [PMC free article] [PubMed] [Google Scholar]
80. He L, et al. Metformin and insulin suppress hepatic gluconeogenesis through phosphorylation of CREB binding protein. Cell. 2009;137:635–646. [PMC free article] [PubMed] [Google Scholar]
81. Fullerton MD, et al. Single phosphorylation sites in Acc1 and Acc2 regulate lipid homeostasis and the insulin-sensitizing effects of metformin. Nat Med. 2013;19:1649–1654. [PMC free article] [PubMed] [Google Scholar]
82. Foretz M, et al. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state. J Clin Invest. 2010;120:2355–2369. [PMC free article] [PubMed] [Google Scholar]
83. Madiraju AK, et al. Metformin suppresses gluconeogenesis by inhibiting mitochondrial glycerophosphate dehydrogenase. Nature. 2014;510:542–546. [PMC free article] [PubMed] [Google Scholar]
84. Cao J, et al. Low concentrations of metformin suppress glucose production in hepatocytes through AMP-activated protein kinase (AMPK) J Biol Chem. 2014;289:20435–20446. [PMC free article] [PubMed] [Google Scholar]
85. Hawley SA, Gadalla AE, Olsen GS, Hardie DG. The antidiabetic drug metformin activates the AMP-activated protein kinase cascade via an adenine nucleotide-independent mechanism. Diabetes. 2002;51:2420–2425. [PubMed] [Google Scholar]
86. Howell JJ, et al. Metformin inhibits hepatic mTORC1 signaling via dose-dependent mechanisms involving AMPK and the TSC complex. Cell Metab. 2017;25:463–471. [PMC free article] [PubMed] [Google Scholar]
87. El-Mir MY, et al. Dimethylbiguanide inhibits cell respiration via an indirect effect targeted on the respiratory chain complex I. J Biol Chem. 2000;275:223–228. [PubMed] [Google Scholar]
88. Hardie DG, Ross FA, Hawley SA. AMPK: a nutrient and energy sensor that maintains energy homeostasis. Nat Rev Mol Cell Biol. 2012;13:251–262. [PMC free article] [PubMed] [Google Scholar]
89. Miller RA, et al. Biguanides suppress hepatic glucagon signalling by decreasing production of cyclic AMP. Nature. 2013;494:256–260. [PMC free article] [PubMed] [Google Scholar]
90. Konopka AR, et al. Hyperglucagonemia mitigates the effect of metformin on glucose production in prediabetes. Cell Rep. 2016;15:1394–1400. [PMC free article] [PubMed] [Google Scholar]
91. Pernicova I, Korbonits M. Metformin — mode of action and clinical implications for diabetes and cancer. Nat Rev Endocrinol. 2014;10:143–156. [PubMed] [Google Scholar]
92. Brown LJ, et al. Normal thyroid thermogenesis but reduced viability and adiposity in mice lacking the mitochondrial glycerol phosphate dehydrogenase. J Biol Chem. 2002;277:32892–32898. [PubMed] [Google Scholar]
93. Saheki T, et al. Citrin/mitochondrial glycerol-3-phosphate dehydrogenase double knock-out mice recapitulate features of human citrin deficiency. J Biol Chem. 2007;282:25041–25052. [PubMed] [Google Scholar]
94. Baur JA, Birnbaum MJ. Control of gluconeogenesis by metformin: does redox trump energy charge? Cell Metab. 2014;20:197–199. [PMC free article] [PubMed] [Google Scholar]
95. Exton JH, Park CR. Control of gluconeogenesis in liver. II. Effects of glucagon, catecholamines, and adenosine 3′,5′-monophosphate on gluconeogenesis in the perfused rat liver. J Biol Chem. 1968;243:4189–4196. [PubMed] [Google Scholar]
96. Lee Y, et al. Hyperglycemia in rodent models of type 2 diabetes requires insulin-resistant alpha cells. Proc Natl Acad Sci USA. 2014;111:13217–13222. [PMC free article] [PubMed] [Google Scholar]
97. Blair JB, Cimbala MA, Foster JL, Morgan RA. Hepatic pyruvate kinase. Regulation by glucagon, cyclic adenosine 3′-5′-monophosphate, and insulin in the perfused rat liver. J Biol Chem. 1976;251:3756–3762. [PubMed] [Google Scholar]
98. Rider MH, et al. 6-Phosphofructo-2-kinase/ fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis. Biochem J. 2004;381:561–579. [PMC free article] [PubMed] [Google Scholar]
99. Wu C, et al. Perturbation of glucose flux in the liver by decreasing F26P2 levels causes hepatic insulin resistance and hyperglycemia. Am J Physiol Endocrinol Metab. 2006;291:E536–E543. [PubMed] [Google Scholar]
100. Cullen KS, Al-Oanzi ZH, O’Harte FPM, Agius L, Arden C. Glucagon induces translocation of glucokinase from the cytoplasm to the nucleus of hepatocytes by transfer between 6-phosphofructo 2-kinase/fructose 2,6-bisphosphatase-2 and the glucokinase regulatory protein. Biochim Biophys Acta. 2014;1843:1123–1134. [PMC free article] [PubMed] [Google Scholar]
101. Romere C, et al. Asprosin, a fasting-induced glucogenic protein hormone. Cell. 2016;165:566–579. [PMC free article] [PubMed] [Google Scholar]
102. Edgerton DS, et al. Effects of insulin on the metabolic control of hepatic gluconeogenesis. in vivo Diabetes. 2009;58:2766–2775. [PMC free article] [PubMed] [Google Scholar]
103. Ramnanan CJ, et al. Molecular characterization of insulin-mediated suppression of hepatic glucose production. in vivo Diabetes. 2010;59:1302–1311. [PMC free article] [PubMed] [Google Scholar]
104. Puigserver P, et al. Insulin-regulated hepatic gluconeogenesis through FOXO1–PGC-1α interaction. Nature. 2003;423:550–555. [PubMed] [Google Scholar]
105. Yoon JC, et al. Control of hepatic gluconeogenesis through the transcriptional coactivator PGC-1. Nature. 2001;413:131–138. [PubMed] [Google Scholar]
106. Nakae J, Kitamura T, Silver DL, Accili D. The forkhead transcription factor Foxo1 (Fkhr) confers insulin sensitivity onto glucose-6-phosphatase expression. J Clin Invest. 2001;108:1359–1367. [PMC free article] [PubMed] [Google Scholar]
107. Schmoll D, et al. Regulation of glucose-6-phosphatase gene expression by protein kinase Bα and the forkhead transcription factor FKHR Evidence for insulin response unit-dependent and -independent effects of insulin on promoter activity. J Biol Chem. 2000;275:36324–36333. [PubMed] [Google Scholar]
108. Matsumoto M. Dual role of transcription factor FoxO1 in controlling hepatic insulin sensitivity and lipid metabolism. J Clin Invest. 2006;116:2464–2472. [PMC free article] [PubMed] [Google Scholar]
109. Haeusler RA, Kaestner KH, Accili D. FoxOs function synergistically to promote glucose production. J Biol Chem. 2010;285:35245–35248. [PMC free article] [PubMed] [Google Scholar]
110. O-Sullivan I, et al. FoxO1 integrates direct and indirect effects of insulin on hepatic glucose production and glucose utilization. Nat Commun. 2015;6:7079. [PMC free article] [PubMed] [Google Scholar]
111. Titchenell PM, Chu Q, Monks BR, Birnbaum MJ. Hepatic insulin signalling is dispensable for suppression of glucose output by insulin in vivo. Nat Commun. 2015;6:7078. [PMC free article] [PubMed] [Google Scholar]
112. Samuel VT, et al. Fasting hyperglycemia is not associated with increased expression of PEPCK or G6Pc in patients with type 2 diabetes. Proc Natl Acad Sci USA. 2009;106:12121–12126. [PMC free article] [PubMed] [Google Scholar]
113. Koo S-H, et al. The CREB coactivator TORC2 is a key regulator of fasting glucose metabolism. Nature. 2005;437:1109–1111. [PubMed] [Google Scholar]
114. Dentin R, et al. Insulin modulates gluconeogenesis by inhibition of the coactivator TORC2. Nature. 2007;449:366–369. [PubMed] [Google Scholar]
115. Wang Y, et al. Inositol-1,4,5-trisphosphate receptor regulates hepatic gluconeogenesis in fasting and diabetes. Nature. 2012;485:128–132. [PMC free article] [PubMed] [Google Scholar]
116. Liu Y, et al. A fasting inducible switch modulates gluconeogenesis via activator/coactivator exchange. Nature. 2008;456:269–273. [PMC free article] [PubMed] [Google Scholar]
117. Wang Y, et al. Targeted disruption of the CREB coactivator Crtc2 increases insulin sensitivity. Proc Natl Acad Sci USA. 2010;107:3087–3092. [PMC free article] [PubMed] [Google Scholar]
118. Hogan MF, et al. Hepatic insulin resistance following chronic activation of the CREB coactivator CRTC2. J Biol Chem. 2015;290:25997–26006. [PMC free article] [PubMed] [Google Scholar]
119. Bass J, Lazar MA. Circadian time signatures of fitness and disease. Science. 2016;354:994–999. [PubMed] [Google Scholar]
120. Zhang EE, et al. Cryptochrome mediates circadian regulation of cAMP signaling and hepatic gluconeogenesis. Nat Med. 2010;16:1152–1156. [PMC free article] [PubMed] [Google Scholar]
121. Lamia KA, et al. Cryptochromes mediate rhythmic repression of the glucocorticoid receptor. Nature. 2011;480:552–556. [PMC free article] [PubMed] [Google Scholar]
122. Lamia KA, Storch K-F, Weitz CJ. Physiological significance of a peripheral tissue circadian clock. Proc Natl Acad Sci USA. 2008;105:15172–15177. [PMC free article] [PubMed] [Google Scholar]
123. Sun Z, et al. Hepatic Hdac3 promotes gluconeogenesis by repressing lipid synthesis and sequestration. Nat Med. 2012;18:934–942. [PMC free article] [PubMed] [Google Scholar]
124. Burgess SC, et al. Cytosolic phosphoenolpyruvate carboxykinase does not solely control the rate of hepatic gluconeogenesis in the intact mouse liver. Cell Metab. 2007;5:313–320. [PMC free article] [PubMed] [Google Scholar]
125. Zingone A, et al. Correction of glycogen storage disease type 1a in a mouse model by gene therapy. J Biol Chem. 2000;275:828–832. [PubMed] [Google Scholar]
126. Bernard C. Leçons de physiologie expérimentale appliquée a la médecine. J.-B. Baillière; 1855. [Google Scholar]
127. Schwartz MW, et al. Cooperation between brain and islet in glucose homeostasis and diabetes. Nature. 2013;503:59–66. [PMC free article] [PubMed] [Google Scholar]
128. Myers MG, Olson DP. Central nervous system control of metabolism. Nature. 2012;491:357–363. [PubMed] [Google Scholar]
129. Perry RJ, Petersen KF, Shulman GI. Pleotropic effects of leptin to reverse insulin resistance and diabetic ketoacidosis. Diabetologia. 2016;59:933–937. [PMC free article] [PubMed] [Google Scholar]
130. Duffy KR, Pardridge WM. Blood–brain barrier transcytosis of insulin in developing rabbits. Brain Res. 1987;420:32–38. [PubMed] [Google Scholar]
131. Plum L, Schubert M, Brüning JC. The role of insulin receptor signaling in the brain. Trends Endocrinol Metab. 2005;16:59–65. [PubMed] [Google Scholar]
132. Brüning JC, et al. Role of brain insulin receptor in control of body weight and reproduction. Science. 2000;289:2122–2125. [PubMed] [Google Scholar]
133. Obici S, Zhang BB, Karkanias G, Rossetti L. Hypothalamic insulin signaling is required for inhibition of glucose production. Nat Med. 2002;8:1376–1382. [PubMed] [Google Scholar]
134. Pocai A, et al. Hypothalamic KATP channels control hepatic glucose production. Nature. 2005;434:1026–1031. [PubMed] [Google Scholar]
135. Kleinridders A, Ferris HA, Cai W, Kahn CR. Insulin action in brain regulates systemic metabolism and brain function. Diabetes. 2014;63:2232–2243. [PMC free article] [PubMed] [Google Scholar]
136. Edgerton DS, et al. Insulin’s direct effects on the liver dominate the control of hepatic glucose production. J Clin Invest. 2006;116:521–527. [PMC free article] [PubMed] [Google Scholar]
137. Ramnanan CJ, et al. Brain insulin action augments hepatic glycogen synthesis without suppressing glucose production or gluconeogenesis in dogs. J Clin Invest. 2011;121:3713–3723. [PMC free article] [PubMed] [Google Scholar]
138. Shulman GI, Landau BR. Pathways of glycogen repletion. Physiol Rev. 1992;72:1019–1035. [PubMed] [Google Scholar]
139. Syed NA, Khandelwal RL. Reciprocal regulation of glycogen phosphorylase and glycogen synthase by insulin involving phosphatidylinositol-3 kinase and protein phosphatase-1 in HepG2 cells. Mol Cell Biochem. 2000;211:123–136. [PubMed] [Google Scholar]
140. Moore MC, et al. Hepatic glucose disposition during concomitant portal glucose and amino acid infusions in the dog. Am J Physiol. 1998;274:E893–E902. [PubMed] [Google Scholar]
141. Gomis RR, Ferrer JC, Guinovart JJ. Shared control of hepatic glycogen synthesis by glycogen synthase and glucokinase. Biochem J. 2000;351:811–816. [PMC free article] [PubMed] [Google Scholar]
142. O’Doherty RM, et al. Differential metabolic effects of adenovirus-mediated glucokinase and hexokinase I overexpression in rat primary hepatocytes. J Biol Chem. 1996;271:20524–20530. [PubMed] [Google Scholar]
143. Niswender KD, Shiota M, Postic C, Cherrington AD, Magnuson MA. Effects of increased glucokinase gene copy number on glucose homeostasis and hepatic glucose metabolism. J Biol Chem. 1997;272:22570–22575. [PubMed] [Google Scholar]
144. Titchenell PM, et al. Direct hepatocyte insulin signaling is required for lipogenesis but is dispensable for the suppression of glucose production. Cell Metab. 2016;23:1154–1166. [PMC free article] [PubMed] [Google Scholar]
145. Velho G, et al. Impaired hepatic glycogen synthesis in glucokinase-deficient (MODY-2) subjects. J Clin Invest. 1996;98:1755–1761. [PMC free article] [PubMed] [Google Scholar]
146. Raimondo A, Rees MG, Gloyn AL. Glucokinase regulatory protein: complexity at the crossroads of triglyceride and glucose metabolism. Curr Opin Lipidol. 2015;26:88–95. [PMC free article] [PubMed] [Google Scholar]
147. Agius L. Glucokinase and molecular aspects of liver glycogen metabolism. Biochem J. 2008;414:1–18. [PubMed] [Google Scholar]
148. Agius L, Peak M, Newgard CB, Gomez-Foix AM, Guinovart JJ. Evidence for a role of glucose-induced translocation of glucokinase in the control of hepatic glycogen synthesis. J Biol Chem. 1996;271:30479–30486. [PubMed] [Google Scholar]
149. Härndahl L, Schmoll D, Herling AW, Agius L. The role of glucose 6-phosphate in mediating the effects of glucokinase overexpression on hepatic glucose metabolism. FEBS J. 2006;273:336–346. [PubMed] [Google Scholar]
150. von Wilamowitz-Moellendorff A, et al. Glucose-6-phosphate-mediated activation of liver glycogen synthase plays a key role in hepatic glycogen synthesis. Diabetes. 2013;62:4070–4082. [PMC free article] [PubMed] [Google Scholar]
151. Bollen M, Keppens S, Stalmans W. Specific features of glycogen metabolism in the liver. Biochem J. 1998;336:19–31. [PMC free article] [PubMed] [Google Scholar]
152. Ros S, García-Rocha M, Domínguez J, Ferrer JC, Guinovart JJ. Control of liver glycogen synthase activity and intracellular distribution by phosphorylation. J Biol Chem. 2009;284:6370–6378. [PubMed] [Google Scholar]
153. Bultot L, et al. AMP-activated protein kinase phosphorylates and inactivates liver glycogen synthase. Biochem J. 2012;443:193–203. [PubMed] [Google Scholar]
154. Ros S, et al. Hepatic overexpression of a constitutively active form of liver glycogen synthase improves glucose homeostasis. J Biol Chem. 2010;285:37170–37177. [PMC free article] [PubMed] [Google Scholar]
155. Cohen P. The Croonian Lecture 1998. Identification of a protein kinase cascade of major importance in insulin signal transduction. Phil Trans R Soc B. 1999;354:485–495. [PMC free article] [PubMed] [Google Scholar]
156. Wan M, et al. A noncanonical, GSK3-independent pathway controls postprandial hepatic glycogen deposition. Cell Metab. 2013;18:99–105. [PMC free article] [PubMed] [Google Scholar]
157. Kitamura T, et al. Insulin-induced phosphorylation and activation of cyclic nucleotide phosphodiesterase 3B by the serine–threonine kinase Akt. Mol Cell Biol. 1999;19:6286–6296. [PMC free article] [PubMed] [Google Scholar]
158. Jurczak MJ, Danos AM, Rehrmann VR, Brady MJ. The role of protein translocation in the regulation of glycogen metabolism. J Cell Biochem. 2008;104:435–443. [PubMed] [Google Scholar]
159. Alemany S, Cohen P. Phosphorylase a is an allosteric inhibitor of the glycogen and microsomal forms of rat hepatic protein phosphatase-1. FEBS Lett. 1986;198:194–202. [PubMed] [Google Scholar]
160. Carabaza A, Ciudad CJ, Baqué S, Guinovart JJ. Glucose has to be phosphorylated to activate glycogen synthase, but not to inactivate glycogen phosphorylase in hepatocytes. FEBS Lett. 1992;296:211–214. [PubMed] [Google Scholar]
161. Samuel VT, Shulman GI. The pathogenesis of insulin resistance: integrating signaling pathways and substrate flux. J Clin Invest. 2016;126:12–22. [PMC free article] [PubMed] [Google Scholar]
162. Olefsky JM, Glass CK. Macrophages, inflammation, and insulin resistance. Annu Rev Physiol. 2010;72:219–246. [PubMed] [Google Scholar]
163. Tolman KG, Fonseca V, Dalpiaz A, Tan MH. Spectrum of liver disease in type 2 diabetes and management of patients with diabetes and liver disease. Diabetes Care. 2007;30:734–743. [PubMed] [Google Scholar]
164. Lee YH, Wang M-Y, Yu X-X, Unger RH. Glucagon is the key factor in the development of diabetes. Diabetologia. 2016;59:1372–1375. [PubMed] [Google Scholar]
165. Henry RR, Scheaffer L, Olefsky JM. Glycemic effects of intensive caloric restriction and isocaloric refeeding in noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab. 1985;61:917–925. [PubMed] [Google Scholar]
166. American Diabetes Association. 6 Obesity management for the treatment of type 2 diabetes. Diabetes Care. 2016;39:S47–S51. [PubMed] [Google Scholar]
167. Lefebvre PJ, Luyckx AS. Glucagon and diabetes: a reappraisal. Diabetologia. 1979;16:347–354. [PubMed] [Google Scholar]
168. Lotfy M, Kalasz H, Szalai G, Singh J, Adeghate E. Recent progress in the use of glucagon and glucagon receptor antagonists in the treatment of diabetes mellitus. Open Med Chem J. 2014;8:28–35. [PMC free article] [PubMed] [Google Scholar]
169. Bagger JI, Knop FK, Holst JJ, Vilsbøll T. Glucagon antagonism as a potential therapeutic target in type 2 diabetes. Diabetes Obes Metab. 2011;13:965–971. [PubMed] [Google Scholar]
170. Habegger KM, et al. The metabolic actions of glucagon revisited. Nat Rev Endocrinol. 2010;6:689–697. [PMC free article] [PubMed] [Google Scholar]
171. Reaven GM, Chen YD, Golay A, Swislocki AL, Jaspan JB. Documentation of hyperglucagonemia throughout the day in nonobese and obese patients with noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab. 1987;64:106–110. [PubMed] [Google Scholar]
172. Baron AD, Schaeffer L, Shragg P, Kolterman OG. Role of hyperglucagonemia in maintenance of increased rates of hepatic glucose output in type II diabetics. Diabetes. 1987;36:274–283. [PubMed] [Google Scholar]
173. Woerle HJ, et al. Mechanisms for abnormal postprandial glucose metabolism in type 2 diabetes. Am J Physiol Endocrinol Metab. 2006;290:E67–E77. [PubMed] [Google Scholar]
174. Menge BA, et al. Loss of inverse relationship between pulsatile insulin and glucagon secretion in patients with type 2 diabetes. Diabetes. 2011;60:2160–2168. [PMC free article] [PubMed] [Google Scholar]
175. Lee Y, et al. Metabolic manifestations of insulin deficiency do not occur without glucagon action. Proc Natl Acad Sci USA. 2012;109:14972–14976. [PMC free article] [PubMed] [Google Scholar]
176. Neumann UH, et al. Glucagon receptor gene deletion in insulin knockout mice modestly reduces blood glucose and ketones but does not promote survival. Mol Metab. 2016;5:731–736. [PMC free article] [PubMed] [Google Scholar]
177. Petersen KF, Sullivan JT. Effects of a novel glucagon receptor antagonist (Bay 27–9955) on glucagon-stimulated glucose production in humans. Diabetologia. 2001;44:2018–2024. [PubMed] [Google Scholar]
178. Guan H-P, et al. Glucagon receptor antagonism induces increased cholesterol absorption. J Lipid Res. 2015;56:2183–2195. [PMC free article] [PubMed] [Google Scholar]
179. Kelly RP, et al. Short-term administration of the glucagon receptor antagonist LY2409021 lowers blood glucose in healthy people and in those with type 2 diabetes. Diabetes Obes Metab. 2015;17:414–422. [PubMed] [Google Scholar]
180. Kazda CM, et al. Evaluation of efficacy and safety of the glucagon receptor antagonist LY2409021 in patients with type 2 diabetes: 12- and 24-week phase 2 studies. Diabetes Care. 2016;39:1241–1249. [PubMed] [Google Scholar]
181. Longuet C, et al. The glucagon receptor is required for the adaptive metabolic response to fasting. Cell Metab. 2008;8:359–371. [PMC free article] [PubMed] [Google Scholar]
182. Vatner DF, et al. Thyroid hormone receptor-β agonists prevent hepatic steatosis in fat-fed rats but impair insulin sensitivity via discrete pathways. Am J Physiol Endocrinol Metab. 2013;305:E89–E100. [PMC free article] [PubMed] [Google Scholar]
183. Martagón AJ, Lin JZ, Cimini SL, Webb P, Phillips KJ. The amelioration of hepatic steatosis by thyroid hormone receptor agonists is insufficient to restore insulin sensitivity in ob/ob mice. PLoS ONE. 2015;10:e0122987. [PMC free article] [PubMed] [Google Scholar]
184. Finan B, et al. Chemical hybridization of glucagon and thyroid hormone optimizes therapeutic impact for metabolic disease. Cell. 2016;167:843–857 e14. [PubMed] [Google Scholar]
185. Armstrong MJ, et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet. 2016;387:679–690. [PubMed] [Google Scholar]
186. Finan B, et al. A rationally designed monomeric peptide triagonist corrects obesity and diabetes in rodents. Nat Med. 2015;21:27–36. [PubMed] [Google Scholar]
187. Soccio RE, Chen ER, Lazar MA. Thiazolidinediones and the promise of insulin sensitization in type 2 diabetes. Cell Metab. 2014;20:573–591. [PMC free article] [PubMed] [Google Scholar]
188. Mayerson AB, et al. The effects of rosiglitazone on insulin sensitivity, lipolysis, and hepatic and skeletal muscle triglyceride content in patients with type 2 diabetes. Diabetes. 2002;51:797–802. [PMC free article] [PubMed] [Google Scholar]
189. Belfort R, et al. A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis. N Engl J Med. 2006;355:2297–2307. [PubMed] [Google Scholar]
190. Gastaldelli A, et al. Importance of changes in adipose tissue insulin resistance to histological response during thiazolidinedione treatment of patients with nonalcoholic steatohepatitis. Hepatology. 2009;50:1087–1093. [PubMed] [Google Scholar]
191. Rizos CV, Kei A, Elisaf MS. The current role of thiazolidinediones in diabetes management. Arch Toxicol. 2016;90:1861–1881. [PubMed] [Google Scholar]
192. Tunaru S, et al. PUMA-G and HM74 are receptors for nicotinic acid and mediate its anti-lipolytic effect. Nat Med. 2003;9:352–355. [PubMed] [Google Scholar]
193. Phan BAP, et al. Effects of niacin on glucose levels, coronary stenosis progression, and clinical events in subjects with normal baseline glucose levels (<100 mg/ dl): a combined analysis of the Familial Atherosclerosis Treatment Study (FATS), HDL-Atherosclerosis Treatment Study (HATS), Armed Forces Regression Study (AFREGS), and Carotid Plaque Composition by MRI during lipid-lowering (CPC) study. Am J Cardiol. 2013;111:352–355. [PMC free article] [PubMed] [Google Scholar]
194. Guyton JR. Niacin in cardiovascular prevention: mechanisms, efficacy, and safety. Curr Opin Lipidol. 2007;18:415–420. [PubMed] [Google Scholar]
195. Kroon T, Kjellstedt A, Thalén P, Gabrielsson J, Oakes ND. Dosing profile profoundly influences nicotinic acid’s ability to improve metabolic control in rats. J Lipid Res. 2015;56:1679–1690. [PMC free article] [PubMed] [Google Scholar]
196. Gerich JE, Meyer C, Woerle HJ, Stumvoll M. Renal gluconeogenesis: its importance in human glucose homeostasis. Diabetes care. 2001;24:382–391. [PubMed] [Google Scholar]
197. Garrett Reginald H, CMG . Principles of Biochemistry with a Human Focus. USA: Brooks/Cole, Thomson Learning; 2002. [Google Scholar]
198. O’Brien RM, Lucas PC, Forest CD, Magnuson MA, Granner DK. Identification of a sequence in the PEPCK gene that mediates a negative effect of insulin on transcription. Science. 1990;249:533–537.[PubMed] [Google Scholar]
199. Magnusson I, Rothman DL, Katz LD, Shulman RG, Shulman GI. Increased rate of gluconeogenesis in type II diabetes mellitus. A 13C nuclear magnetic resonance study. The Journal of clinical investigation. 1992;90:1323–1327. [PMC free article] [PubMed] [Google Scholar]
200. Gastaldelli A, Toschi E, Pettiti M, Frascerra S, Quinones-Galvan A, Sironi AM, Natali A, Ferrannini E. Effect of physiological hyperinsulinemia on gluconeogenesis in nondiabetic subjects and in type 2 diabetic patients. Diabetes. 2001;50:1807–1812. [PubMed] [Google Scholar]
201. Petersen KF, Laurent D, Rothman DL, Cline GW, Shulman GI. Mechanism by which glucose and insulin inhibit net hepatic glycogenolysis in humans. The Journal of clinical investigation. 1998;101:1203–1209. [PMC free article] [PubMed] [Google Scholar]
202. Edgerton DS, Lautz M, Scott M, Everett CA, Stettler KM, Neal DW, Chu CA, Cherrington AD. Insulin’s direct effects on the liver dominate the control of hepatic glucose production. The Journal of clinical investigation. 2006;116:521–527. [PMC free article] [PubMed] [Google Scholar]
203. Williamson JR, Wright PH, Malaisse WJ, Ashmore J. Control of gluconeogenesis by acetyl CoA in rats treated with glucagon and anti-insulin serum. Biochemical and biophysical research communications. 1966;24:765–770. [PubMed] [Google Scholar]
204. Mondon CE, Mortimore GE. Effects of insulin on amino acid release and urea formation in perfused rat liver. The American journal of physiology. 1967;212:173–178. [PubMed] [Google Scholar]
205. Girard J. Insulin’s effect on the liver: “direct or indirect?” continues to be the question. The Journal of clinical investigation. 2006;116:302–304. [PMC free article] [PubMed] [Google Scholar]
206. IOS, Zhang W, Wasserman DH, Liew CW, Liu J, Paik J, DePinho RA, Stolz DB, Kahn CR, Schwartz MW, Unterman TG. FoxO1 integrates direct and indirect effects of insulin on hepatic glucose production and glucose utilization. Nature communications. 2015;6:7079. [PMC free article] [PubMed] [Google Scholar]
207. Ravier MA, Rutter GA. Glucose or insulin, but not zinc ions, inhibit glucagon secretion from mouse pancreatic alpha-cells. Diabetes. 2005;54:1789–1797. [PubMed] [Google Scholar]
208. Altarejos JY, Montminy M. CREB and the CRTC co-activators: sensors for hormonal and metabolic signals. Nature reviews. Molecular cell biology. 2011;12:141–151. [PMC free article] [PubMed] [Google Scholar]
209. Sharabi K, Tavares CD, Rines AK, Puigserver P. Molecular pathophysiology of hepatic glucose production. Molecular aspects of medicine. 2015;46:21–33. [PMC free article] [PubMed] [Google Scholar]
210. Kawamori D, Kurpad AJ, Hu J, Liew CW, Shih JL, Ford EL, Herrera PL, Polonsky KS, McGuinness OP, Kulkarni RN. Insulin signaling in alpha cells modulates glucagon secretion in vivo. Cell metabolism. 2009;9:350–361. [PMC free article] [PubMed] [Google Scholar]
211. Fisher SJ, Kahn CR. Insulin signaling is required for insulin’s direct and indirect action on hepatic glucose production. The Journal of clinical investigation. 2003;111:463–468. [PMC free article] [PubMed] [Google Scholar]
212. Lewis GF, Vranic M, Harley P, Giacca A. Fatty acids mediate the acute extrahepatic effects of insulin on hepatic glucose production in humans. Diabetes. 1997;46:1111–1119. [PubMed] [Google Scholar]
213
. Morton GJ, Schwartz MW. Leptin and the central nervous system control of glucose metabolism. Physiological reviews. 2011;91:389–411. [PMC free article] [PubMed] [Google Scholar]
214. Buettner C, Patel R, Muse ED, Bhanot S, Monia BP, McKay R, Obici S, Rossetti L. Severe impairment in liver insulin signaling fails to alter hepatic insulin action in conscious mice. The Journal of clinical investigation. 2005;115:1306–1313. [PMC free article] [PubMed] [Google Scholar]
215. Lu M, Wan M, Leavens KF, Chu Q, Monks BR, Fernandez S, Ahima RS, Ueki K, Kahn CR, Birnbaum MJ. Insulin regulates liver metabolism in vivo in the absence of hepatic Akt and Foxo1. Nature medicine. 2012;18:388–395. [PMC free article] [PubMed] [Google Scholar]
216. Titchenell PM, Chu Q, Monks BR, Birnbaum MJ. Hepatic insulin signalling is dispensable for suppression of glucose output by insulin in vivo. Nature communications. 2015;6:7078. [PMC free article][PubMed] [Google Scholar]
217. Perry RJ, Camporez JP, Kursawe R, Titchenell PM, Zhang D, Perry CJ, Jurczak MJ, Abudukadier A, Han MS, Zhang XM, Ruan HB, Yang X, Caprio S, Kaech SM, Sul HS, Birnbaum MJ, Davis RJ, Cline GW, Petersen KF, Shulman GI. Hepatic acetyl CoA links adipose tissue inflammation to hepatic insulin resistance and type 2 diabetes. Cell. 2015;160:745–758. [PMC free article] [PubMed] [Google Scholar]
218. Barthel A, Schmoll D. Novel concepts in insulin regulation of hepatic gluconeogenesis. American journal of physiology. Endocrinology and metabolism. 2003;285:E685–692. [PubMed] [Google Scholar]
219. Samuel VT, Beddow SA, Iwasaki T, Zhang XM, Chu X, Still CD, Gerhard GS, Shulman GI. Fasting hyperglycemia is not associated with increased expression of PEPCK or G6Pc in patients with Type 2 Diabetes. Proceedings of the National Academy of Sciences of the United States of America. 2009;106:12121–12126. [PMC free article] [PubMed] [Google Scholar]
220. Valenti L, Rametta R, Dongiovanni P, Maggioni M, Fracanzani AL, Zappa M, Lattuada E, Roviaro G, Fargion S. Increased expression and activity of the transcription factor FOXO1 in nonalcoholic steatohepatitis. Diabetes. 2008;57:1355–1362. [PubMed] [Google Scholar]
221. Ratziu V, Charlotte F, Heurtier A, Gombert S, Giral P, Bruckert E, Grimaldi A, Capron F, Poynard T, Group LS. Sampling variability of liver biopsy in nonalcoholic fatty liver disease. Gastroenterology. 2005;128:1898–1906. [PubMed] [Google Scholar]
222. Rizza RA. Pathogenesis of fasting and postprandial hyperglycemia in type 2 diabetes: implications for therapy. Diabetes. 2010;59:2697–2707. [PMC free article] [PubMed] [Google Scholar]
223. Lizcano JM, Alessi DR. The insulin signalling pathway. Current biology : CB. 2002;12:R236–238.[PubMed] [Google Scholar]
224. Withers DJ, Gutierrez JS, Towery H, Burks DJ, Ren JM, Previs S, Zhang Y, Bernal D, Pons S, Shulman GI, Bonner-Weir S, White MF. Disruption of IRS-2 causes type 2 diabetes in mice. Nature. 1998;391:900–904. [PubMed] [Google Scholar]
225. Tamemoto H, Kadowaki T, Tobe K, Yagi T, Sakura H, Hayakawa T, Terauchi Y, Ueki K, Kaburagi Y, Satoh S, et al. Insulin resistance and growth retardation in mice lacking insulin receptor substrate-1. Nature. 1994;372:182–186. [PubMed] [Google Scholar]